|
Dátum: 2007. november 12. 00:00:00. Forrás : Origo |
Megkezdődött az epigenomika korszaka. Vajon hogyan jön létre szervezetünk sejtjeinek ámulatba ejtő változatossága, amikor minden egyes sejtünk ugyanazt a genetikai információt hordozza? A válasz részben a DNS különleges csomagolásában rejlik. A kutatók most kezdik feltérképezni azokat a sejttípusokra jellemző különbségeket, amelyek bonyolult módon szabályozzák, milyen információ olvasható ki örökítőanyagunkból.
Új korszak kezdődik a sejtbiológiában. Sorra jelennek meg a szakfolyóiratokban a cikkek, kötük a Nature magazinban, amelyek arra keresik a választ, miként képes ugyanaz a genetikai állomány egészen eltérően kifejeződni, és sokféle különböző sejttípust létrehozni. A DNS-molekula szerkezetét és az ember genetikai állományának (genomjának) szekvenciáját nagyjából ismerjük. A napjainkban kezdődő poszt-genomikai kutatások célja megérteni a genom egészének komplexitását, szerkezetét és rendszerként való működését.
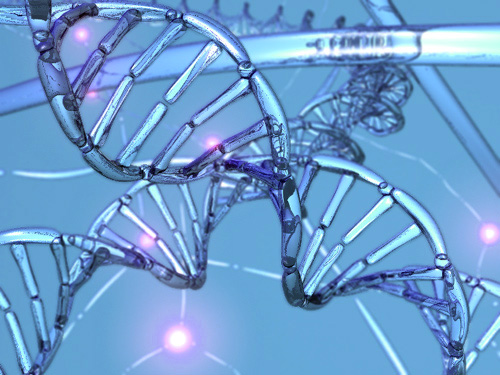
A sejtbiológusok egyre gyakrabban tanulmányozzák a hiszton nevű fehérjék és a DNS-molekulák kapcsolatát. Megpróbálják megérteni, hogyan befolyásolják a gének kifejeződését ezek a DNS-molekula csomagolásáért felelős fehérjék. A DNS-molekula és a hisztonok együtt alkotják az ún. kromatinállományt. A kromatin állapota döntően befolyásolja a genomi régiók aktivitását. Ha örökítőanyagunk "hardverében", a DNS-ben eltárolt szerves bázisok sorrendjét (szekvenciáját) tekintjük a feldolgozandó információnak, akkor a kromatin állapotát nevezhetjük a szoftvernek, amely az információ kiolvasását irányítja.
Azokat az öröklődő különbségeket, amelyek nem a DNS szekvenciájában jelentkeznek, de befolyásolják génjeink kifejeződését, epigenetikai különbségeknek nevezzük. Az ilyen eltérések adnak rá magyarázatot, miként képes szervezetünk oly sokféle szövettípust létrehozni az embrionális fejlődés során, és hogyan tud a felnőttkorban a sejtek megújulása révén alkalmazkodni a külső hatásokhoz. Bizonyos betegségek - például a rák - hátterében a genetikai változások mellett epigenetikai változások is állnak. Az epigenetikai eltérések genomléptékű (teljes örökítőanyagunkra kiterjedő) feltérképezésével egy új tudományág, az epigenomika foglalkozik.
Csomagolástechnika és összetett szabályozás
Hihetetlennek hangzik, de minden sejtünk kb. 2 méter hosszú DNS-molekulát hordoz. Ahhoz, hogy örökítőanyagunk beférjen egy apró, 10-20 mikrométer (10-20 milliomod méter) átmérőjű sejtmagba, nagyon hatékony "csomagolástechnikára" van szükség. A kromatinállomány tehát nem más, mint sűrűn összecsomagolt genetikai információ. A csomagolás módja természetesen azt is befolyásolja, hogy az információnak mely része hozzáférhető a sejt számára. Nem csoda, hogy a kromatin szerveződése a génszabályozásban is fontos szerepet játszik.
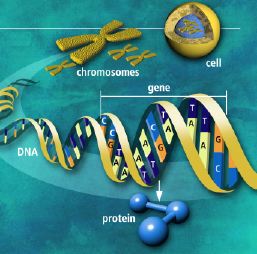
A kromatinállomány alapegysége az ún. nukleoszóma, amely nyolc hisztonfehérjéből és a rájuk feltekeredő DNS-molekulából áll. Ez a szerkezet legalább háromféleképpen szabályozza a genetikai információ kifejeződését. Minél lazábban van "csomagolva" a DNS-molekula a kromatinállomány egyes területein (tehát minél távolabb helyezkednek el a nukleoszómák egymástól), annál aktívabb azon a szakaszon a gének átírása. Egyes fehérjék képesek átszervezni (lazítani) a kromatin szerkezetét, így fontos szerepet játszanak a génkifejeződés szabályozásában. A nukleoszómák ezen kívül egy magas szinten szervezett, "zártabb" szerkezetbe, ún. heterokromatinba rendeződhetnek. Ez az állapotot nem kedvez a génátírásnak. A nyitottabb és zártabb kromatinszakaszok között kialakuló egyensúly nagyon fontos a különböző sejttípusok kialakításához.
A hisztonfehérjék aminosavjait módosító enzimek bonyolult összjátéka szintén kulcsfontosságú a génátírás szabályozásában. Néhány speciális enzim kovalens kötés segítségével különböző funkciós csoportokat "ragaszthat" a hisztonok oldalláncaira. A hisztonfehérjék ilyen kémiai módosításait korábban úgy értelmezték, mintha a génátírást közvetlenül irányító molekuláris kapcsolók volnának. Kézenfekvő feltételezni, hogy ezek a kétállapotú kapcsolók aktivizálják vagy némítják el a géneket. Kezdetben e leegyszerűsített modell elegendőnek is bizonyult, de ma már egyre világosabban látjuk: a kromatinállomány nyitottsága-zártsága, a nukleoszómák szerveződése és a hisztonfehérjék kémiai módosításai együttesen alkotnak egy szabályozó rendszert. A felsorolt faktorok közösen döntik el, milyen intenzíven fejeződik ki az adott sejtben egy gén vagy egy géncsoport. Szó sincs tehát egyszerű, kétállapotú molekuláris kapcsolókról.

Térkép a módosult hisztonfehérjékről
A közelmúltban két neves tudományos folyóirat is foglalkozott ezzel a bonyolult szabályozó rendszerrel. A kutatók a teljes emberi genomban található hisztonmódosításokat csoportosították. Tarjei S. Mikkelsen és munkatársai (Harvard University és MIT) a Nature folyóiratban közzétett munkájukban részletesen elemezték, mennyire térnek el az éretlen és az érett, felnőtt sejteknél e paraméterek. Artem Barski (NHLBI) és kollégái a Cell című folyóiratban publikált vizsgálatukban kizárólag érettebb sejttípusokkal foglalkoztak. A két kutatócsoport egy ötletes új eljárás, az ún. Solexa 1G szekvenálás segítségével határozta meg, pontosan milyen hisztonmódosítási mintázat jellemző a genom egyes régióira. Az eredmények egyértelműen kimutatták, hogy a hisztonmódosítások és a DNS "csomagolása" együtt döntik el, mennyire legyen intenzív a gének átírása az adott genomrégióban.
Érdekes módon a kutatók olyan területeket is találtak a genomban, amelyek génkifejeződési aktivitása nincsen összhangban a helyi hisztonfehérjék módosításaival. Ez egybecseng azzal a népszerű elképzeléssel, miszerint a genomnak jóval nagyobb része íródik át DNS-ről RNS-re, mint korábban gondoltuk. Örökítőanyagunk nem csak a klasszikus "hírvivő"-RNS-eket kódolja, amelyek a fehérjék szerkezetéhez szükséges információt hordozzák. A genom számos régiójáról fehérjéket nem kódoló RNS-ek is átíródnak, amelyek elsősorban a génszabályozásban játszanak fontos szerepet. Úgy tűnik, e fehérjét nem kódoló genomi szakaszoknál nem jelennek meg a fehérjekódoló régiók mentén felfedezett hisztonmódosítási mintázatok.
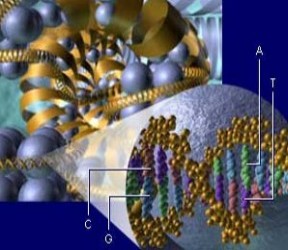
Mindaz, amit jelenleg a DNS "csomagolásáról" tudunk, csak lineáris vetülete lehet annak a háromdimenziós struktúrának, amely a génátírást a valóságban szabályozza. A nukleoszómák háromdimenziós szerkezeteket alakíthatnak ki - ezek a térbeli alakzatok veszik körül az egyes géneket, géncsoportokat és a génátírást szabályozó régiókat. Így jön létre az a rendkívül komplex rendszer, amelyet a genom topográfiájának nevezhetünk. A génszabályozás pontos megértéséhez talán a genom háromdimenziós topográfiáját is fel kell majd térképezni.
Markó Károly
Van jó témaötleted? Írj nekünk egy vendégcikket!
Kapcsolódó olvasnivalók
Nyerőgépes játékok evolúciója
A nyerőgépes játékok a szerencsejáték olyan egyszerűen játszható formáját jelentik, amely számos országban azonos alapelvekre épül, az 1800-as évektől kezdve szinte változatlan formában. Az angolul slot machine néven ismert gépek háromorsós változatai mind a mai napig használhatók.
A Goldenhar szindróma
A Goldenhar szindróma egy ritka veleszületett fejlődési rendellenesség, amely hatással lehet az arcra, a szemekre, a fülre és az állkapocsra, illetve a belső szervekre is. Maurice Goldenhar francia orvos munkájának elismeréseként nevezték így el, aki először írta le (1952). Ebben a cikkben a betegség jellemzőit, okait, diagnózisát és kezelési lehetőségeit vizsgáljuk meg.
Tücsök és Hangya :)
A klasszikus verzió: A hangya a forró nyarat szorgalmasan végigdolgozta, építgette, szépítgette házát, és élelmet halmozott fel felkészülvén a kemény télre. A tücsök úgy gondolta, a hangya bolond, és végigmulatta a nyarat. Eljött a tél, a hangya nem fázott és nem éhezett, ám a tücsök élelem és szállás híján a hidegben lelte halálát.
Kapcsolódó doksik
- Jung-Wajand - Az atomos és molekuláris hidrogén redukálóképességének összehasonlítása
2018, 6 oldal - Haskó György - Egy páratlan egész szám legalább egy törzsosztójának megkeresése számjegyei összegének felhasználásával, ha a vizsgált szám összetett
2016, 14 oldal - A kollagénrost és elasztikus rost szintézise
2013, 3 oldal - Sztóma, mint az élet megrontója, egyben a további, emberhez méltó élet lehetőségének bölcsője
2013, 32 oldal - Göbölyös-Réger - Lokális energiaforrások távhő célú felhasználási lehetőségének vizsgálata
2016, 4 oldal
