Datasheet
Year, pagecount:2010, 130 page(s)
Language:Hungarian
Downloads:19
Uploaded:July 01, 2023
Size:3 MB
Institution:
[SE] Semmelweis University
Comments:
Attachment:-
Download in PDF:Please log in!
Comments
No comments yet. You can be the first!
What did others read after this?
Content extract
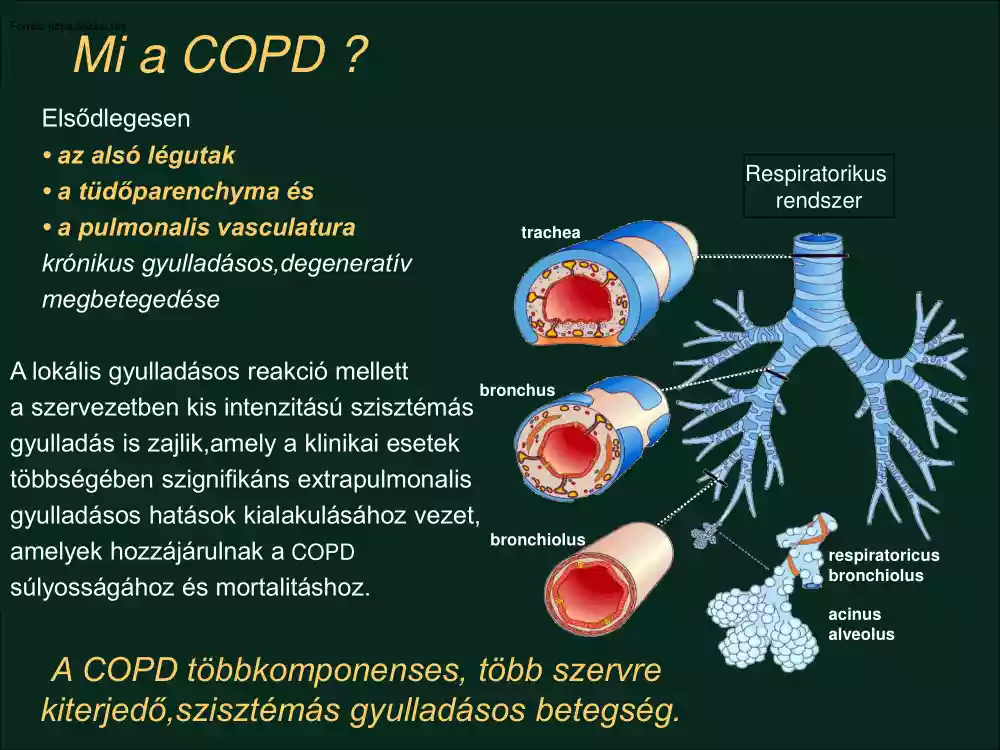
Mi a COPD ? Elsődlegesen • az alsó légutak • a tüdőparenchyma és • a pulmonalis vasculatura krónikus gyulladásos,degeneratív megbetegedése Respiratorikus rendszer trachea A lokális gyulladásos reakció mellett bronchus a szervezetben kis intenzitású szisztémás gyulladás is zajlik,amely a klinikai esetek többségében szignifikáns extrapulmonalis gyulladásos hatások kialakulásához vezet, bronchiolus amelyek hozzájárulnak a COPD súlyosságához és mortalitáshoz. respiratoricus bronchiolus acinus alveolus A COPD többkomponenses, több szervre kiterjedő,szisztémás gyulladásos betegség. Tünetek Terhelési limitáció Életminőség Exacerbációk etc. COPD Krónikus bronchitis Emphysema Szisztémás gyulladásos hatások • Súlyvesztés (cachexia) Áramláskorlátozottság Obstruktív bronchiolitis • Vázizom diszfunkció • Cardiovascularis események • Osteoporosis • Depressio Szisztémás gyulladás Agusti AGN. Respir Med
200599: 670-682 • Carcinoma A definiált elemek egy entitásként (COPD) foglalhatók össze Krónikus bronchitis Obstruktív bronchiolitis COPD Szisztémás gyulladásos hatások Emphysema • A COPD eltérő kórfejlődésű elemei [krónikus bronchitis, obstruktiv bronchiolitis, emphysema, extrapulmonalis (szisztémás) gyulladásos hatások] általában egymással társulva, gyakran jelentősebb interindividuális különbségekkel járulnak hozzá a COPD patofiziológiájához és tüneteihez úgy, hogy egy adott betegnél a légúti („bronchitises”) vagy parenchymás („emphysemás”) elemek döminanciája feltűnő lehet. • Az egyes elemek önálló entitásként is előfordulhatnak, de a COPD valóban tisztán „bronchitiszes” („B”- típusú COPD) -,vagy „emphysemás” („A”- típusú COPD) fenotípusai inkább csak kivételek. Centrilobularis (centriacinaris) (A,B) és panlobularis (panacinaris) emphysema (C,D) COPD-ben A Konfluáló resp.
bronchiolusok (RB1,2,3) az acinus centrumában C C Alveolusok diffúz destrukciója és összeolvadása az acinusban B D D A súlyos emphysema klinikai fenotípusai „Pink puffer” „Emphysemás”(A)-Tipus „Blue bloater” „Bronchitiszes” (B)-Tipus COPD: definició A Global Initiative for Chronic Obstructive Lung Disease (GOLD,2006) meghatározása szerint: „ A COPD (Chronic Obstructive Pulmonary Disease) olyan kórállapot, amelyet nem teljesen reverzibilis kilégzési áramláskorlátozottság jellemez. Az áramláskorlátozottság általában progresszív és a tüdők abnormális gyulladásos reakciójával kapcsolatos, melyet toxikus részecskék vagy gázok ( főleg dohányfüst) krónikus belégzése vált ki. A COPD megelőzhető és kezelhető betegség, számos szignifikáns extrapulmonalis (szisztémás) hatással, melyek hozzájárulnak a betegség pulmonalis hatásaihoz és súlyosságához”. A COPD alapvető patofiziológiai jellemzői A
krónikus, progresszív, nem teljesen reverzibilis vagy irreverzibilis Kilégzési áramláskorlátozottság kilégzési hajtónyomás (parenchyma) áramlási ellenállás (kis légutak) Air trapping Dinamikus hyperinfláció Air trapping és dinamikus hyperinfláció COPD-ben Kilégzési áramláskorlátozottság Az áramláskorlátozottság növekedésével a tüdők kiürülése lassul: a kilégzési fázis nem teszi lehetővé a komplett kilégzést a respiratorikus rendszer (mellkasfal-tüdő) statikus (relaxációs) térfogat szintjéig (a belégzett levegő egy része ”fogva marad” a tüdőkben) Air trapping • optimalizálja a kilégzési áramlás generálását • súlyos restriktív mechanikai deficitet eredményez Krónikus dinamikus hyperinfláció (részlegesen reverzibilis) Légzési frekvencia növekedése (pl. terhelés, AE, PaO2 ) Air trapping akut fokozódása Akut dinamikus hyperinfláció (dominálóan reverzibilis) A kilégzési
áramláskorlátozottság mechanizmusai COPD-ben Kis légutak (obstruktív bronchiolitis) • A falak gyulladásos strukturális átépülése, megvastagodása a lumen rovására (remodeling), fibrosisa(fixált szükületek), simaizom hyperplasia • Fokozott paraszimpatikus aktivitás • (simaizom konstrikció) • Falstabilitás elvesztése Surfactant „Kipányvázottság” • Luminalis okklúzió Légúti áramlási ellenállás Parenchyma (emphysema) Alveolaris falpusztulás • - alveoláris”kötődések”destrukciója • - elasztikus összehúzó erő csökken • - perifériás légterek nőnek • Capillaris hálózat pusztulása Kilégzési hajtónyomás Kilégzési áramláskorlátozottság A COPD progressziójával (GOLD III/IV.stádium) a perifériás légutak lumenében a gyulladásos mucosus exsudátum volumene szignifikánsan nő Hogg JC,et al. NEJM 2004350:2645-2653 A B Lumen Luminális tartalom Fal A. Perifériás légút nagyon
súlyos B. Ugyanazon légút digitális tükörkép (GOLD IV.stádium) COPD-s beteg manipulációval rekonstruált diagramja teljes kollapszus alatt fixált tüdejéből G • a lumen teljes expandálása után A gyulladás jellemzői (hasonlóságok és különbségek) COPD-ben és asthma bronchiale COPD Gyulladásos sejtek Asthma bronchiale Neutrophilek +++ Macrophagok +++ Tc1 (CD8+) T-sejtek ++ Th1 (CD4+) T-sejtek + B-lymphocyták + Eosinophilek ++ Macrophagok+ Hízósejtek Th2 (CD4+) T-sejtek IL-8, TNF-α, GRO-α, IL-6 IL-1β, NO +, LTB4 Oxidatív stressz +++ IL-4, IL-5, IL-13, Eotaxin RANTES, LTB4, NO +++ Oxidatív stressz + Gyulladás helye Perifériás légutak, Parenchyma, Tüdőerek Főleg a nagy légutak Gyulladásos hatások Laphám-metaplasia, Nyákpangás Kislégúti fibrosis Parenchymapusztulás Vascularis remodeling Epithel denudatio Bazális membrán megvastagodás Terápiás válasz Gyenge hörgőtágító és kortikoszteroid-hatás Kifejezett
hörgőtágító és kortikoszteroid-hatás Mediátork A COPD diagnosztikája Vastag Endre Semmelweis Egyetem Pulmonológiai Klinika COPD-re gyanus betegek kérdőíves kiszűrése GOLD Szakértői Bizottság, 2002. nov COPD gyanúja azoknál a betegeknél merül fel, akik: • A napok többségében köhögnek • A napok többségében köpetet ürítenek • Fizikai aktivitásra a hasonló korosztályba tartozókhoz képest könnyebben kifulladnak • Életkoruk meghaladja a 40 évet • Aktív dohányosok vagy ex-dohányosok Legalább 3 kritérium fennállása esetén a COPD diagnózisának megerősítésére spirometriás vizsgálat szükséges. Diagnosztikus vizsgálatok COPD-ben INDIKÁCIÓ VIZSGÁLAT Alapvizsgálatok* • FEV1/FVC, FEV1 COPD gyanúja esetén • Reverzibilitási próba (inhalációs hörgőtágítóval ) • Mellkasröntgen Kiegészítő vizsgálatok • TGV *, RV, IC, IVC, TLC Középsúlyos/súlyos • TLCO/ KCO * COPD-ben •
Vérgázvizsgálatok • EKG * Járóbeteg szakellátásban, alapellátásban ajánlott * Testpletizmográffal mért térfogat * Az ATS ajánlásaiban „rutinvizsgálat”-ként szerepel Spirometria: a diagnózis arany standardja COPD-ben A FEV1, az FVC és a FEV1 / FVC arány meghatározása FEV (L) 5 FVC Normál FEV1 FVC 4 3 FEV1 COPD 2 1 FEV1 FVC FEV1/FVC Normál 4.15 5.2 80% COPD 2.35 3.9 60% 0 0 1 2 3 4 5 6 Idő (s) Ha a post-bronchodilatátor FEV1 / FVC arány ≤ 70% , diagnosztikus értékű COPD-re GOLD ajánlás (2006) Obstruktív ventilációs zavar: a FEV1 /IVC-hányados (Tiffeneau-index) csökkenése a referenciaértékhez viszonyítva > 1.64 RSD (az index korfüggő) COPD-ben a légúti obstrukció kritikus értéke fix: A post-bronnchodilatátor FEV1 /FVC Térfogat (L) hányados ≤ 70% 5 FVC FEV1 4 FVC 3 FVC FEV1 2 referencia-érték FEV1 1 post-bronchodilatátor pre-bronchodilatátor 0 0 1 2 3 4 5 6 Idő (s)
Post-bronchodilatátor FEV1 / FVC (1.6 L /29 L) = 550 % Post-bronchodilatátor FEV1 (ré.%) (16 L /42 L) = 380 % Δ FEV1 (0.15 L) = 103 % GOLD ajánlás (2006) Akut reverzibilitási próba A kilégzési áramláskorlátozottság reverzibilitásának vizsgálata hörgőtágítókkal,stabil állapotban A vizsgálat célja: • az asthmás és COPD-s betegek elkülönítése* • a post-bronchodilatátor FEV1 meghatározása Az ajánlott hörgőtágító dózisok: 400 µg rövid hatású 2-agonista vagy 80 µg antikolinerg hörgőtágító inhalációja (esetleg kombináltan) adagoló porlasztóból (toldalékkal). Mérések: inhaláció előtt, majd 30-45 perccel utána Értékelés: A kiindulási FEV1 értéket 12 %-kal meghaladó, de legalább 200 ml-es növekedése értékelhető reverzibilitásként Az asthmások ~ 30 %-a „fix”,nem reverzibilis funkciózavart mutat Kestens S,et al. Chest 1994105:1042-45 A nemzetközi diagnosztikus ajánlások által javasolt
reverzibilitási küszöb-értéket (β2-agonista belégzése után a FEV1 12 %-os és legalább 200 mL-es javulása) használva, az asthma azonosításának szenzitivitása 44%,a COPD-től való elkülőnítésének specificitása 72 %. Mannino DM,et al. Arch Intern Med 2000 160:1683-89 * Tüdőfunkciós tesztek alapján az asthma és a COPD között éles határvonal nem húzható. A COPD diagnózisának légzésfunkciós kritériumai (Spirometria: a diagnózis arany standardja!) Spirometriával kimutatható a COPD-re jellemző kilégzési áramláskorlátozottság – Fennállása diagnosztikusnak tekinthető ha a post-bronchodilatátor FEV1/ FVC arány 70 % – Nem teljes reverzibilitása hörgőtágítók után a FEV1 növekedése nem éri el a reverzibilitás küszöbszintjét, azaz a FEV1 < 12 % és < 200 mL – Súlyossági foka a post-bronchodilatátor FEV1 (r.é%) csökkenése alapján itélhető meg – Progresszív romlása hosszabb távon ( 3 év)
a post-bronchodilatátor FEV1 csökkenése > 50 mL/év (a fiziológiás csökkenés mértéke < 30 mL/év) A COPD spirometriás súlyossági fokozatai A COPD súlyossági fokozatai (I-IV.stádium) a postbronchodilatátor (PB) FEV1 (ré%) értékei alapján ítélhető meg: I.stádium Enyhe COPD PB FEV1(ré.%) ≥ 80 % II. stádium Közepesen súlyos COPD PB FEV1(ré.%) 50-79 % III. stádium Súlyos COPD PB FEV1(ré.%) 30-49 % IV. stádium Nagyon súlyos COPD PB FEV1(ré.%) < 30% COPD – progresszió: A légúti funkcióvesztés ütemének mérése prognosztikus értékű A veszélyeztetett csoport kiemelhető A post-bronchodilatátor FEV1-csökkenés megfigyelésével legaláb 3 éven át * („Gold standard”, a mortalitással egyenértékű végpont) * A fiziológiás 25-30 mL/év FEV1 csökkenés helyett az évi térfogatvesztés COPD-ben meghaladja az 50 mL-t Mellkasröntgen COPD-ben • Krónikus bronchitisre utaló jelek: -fokozott
bronchovascularis rajzolat, enyhe fibrosis -nagyobb szív, pulmonalis hypertoniában a jobb oldali arteria pulmonalis törzs átmérője > 16 mm • Emphysemára utaló jelek: -fokozott sugáráteresztés (parenchyma-tömeg/tüdővolumen arány csökkent) -csökkent perifériás vascularisatio, centro-periferiás érkaliber diszkrepancia -lapos, mélyen álló rekesz, tág bordaközök -kiszélesedett pre- és retrocardiális tér -kis, középen elhelyezkedő szív (gyakran cseppszív) (GOLD, 2003) Előrehaladott emphysema • Nagy térfogatú tüdők keskeny szívárnyékkal • A rekesz mindkét oldalon lapos • A transzparencia fokozott a felső lebenyekben, az érrajzolat gyengébb Hansel, Barnes. Atlas of COPD, 2004 Bullosus emphysema • A felső bulla érmentes területként látható a jobb felső lebenyben. A bulla alsó határán a fal egy vékony görbületként válik láthatóvá • A másik bulla a jobb alsó lebenyben látható Hansel, Barnes. Atlas of
COPD, 2004 α1-antitripszin hiány (panacinaris emphysema) • nagy térfogatú tüdők • lelapult,mélyen álló rekeszek • alsó tüdőterületek transzparenciája fokozott,az érrajzolat csökkent Cor pulmonale Krónikus légúti obstrukció, midkét oldalon kitágult pulmonalis artériákkal Cardiomegália (a tranzverz irányú szívátmérő> 50%-a a tranzverz tüdőátmérőnek Panacinaris emphysema Kórosnak tartott, a sugarakat csak kis mértékben elnyelő nagy területek láthatóak a felvételen (a panacinaris parenchyma destrukció következménye) Hansel, Barnes. Atlas of COPD, 2004 CT denzitometria COPD-ben A CT denzitometria kifejlesztése – mnt az emphysema in vivo mértéke – jobb lehetőséget nyújt a COPD individuális fenotípusainak jellemzésére, az emphysemás destrukciónak a FEV1-csökkenéshez való hozzájárulásának mértékéről. α1-AT hiányban sokkal szenzitívebb mértéke a betegség progressziójának,mint a
fiziológiai vagy egészségi állapotot jelző indexek és összefügg a „gold standard”-nak számító FEV1csökkenéssel. Szokványos COPD-ben a klinikai fenotípus általában sokkal heterogénebb mint α1-AThiányban és a CT denzitometria szerepe hosszú távú tanulmányokban még kevésbé bizonyított A COPD progresszióját hosszabb távon hagyományosan a FEV1-vasztés mértéke alapján becsülték fel,de ez az index nem specifikus mértéke az áramláskorlátozottságnak. A COPD heterogén szindróma,részkomponenseinek relatív hozzájárulása az áramláskorlátozottsághoz a FEV1 alapján nem identifikálható. Kiegészítő légzésfunkciós vizsgálatok középsúlyos/súlyos COPD-ben Statikus tüdőtérfogatok és kapacitások meghatározása COPD-re jellemző eltérések: – – TLC, TGV*, RV, IC, IC/TGV % ↓, IVC Az IC és TGV a hyperinfláció érzékeny markere A tüdő transzfer faktorának (diffúziós kapacitás) és
transzfer koefficiensének meghatározása CO-ra – TLCO/KCO : az emphysema súlyosságának markere Vérgázvizsgálat (ha a FEV1 * Testpletizmográffal mért térfogat < 40%, ha cyanosis merül fel) Diagnosztikus vizsgálatok COPD-ben INDIKÁCIÓK VIZSGÁLATOK Alapvizsgálatok CODP gyanúja esetén FEV1/FVC, FEV1, Kiegészítő vizsgálatok középsúlyos/súlyos COPD-ben Tüdőtérfogatok mérése Diffúziós zavar mérése Vérgázanalízis, EKG, Htk/Hb Purulens köpet Fiatalkori emphysema Asthma gyanúja Emphysema típusa/kiterjedése Obstruktív alvási apnoe Reverzibilitási próba Mellkasröntgen Köpettenyésztés, antibiogram Alfa1-antitripszin szérumszint PEF-monitorozás, terheléses vizsgálat,bronchialis reaktivitás HRCT Alvás alatti légzésvizsgálat A stabil COPD kezelése Vastag Endre Semmelweis Egyetem Pulmonológiai Klinika A kezelés célja COPD-ben • • • • • • • A rizikó tényezők csökkentése A progresszív
légúti funkcióvesztés megelőzése/fékezése A tünetek enyhítése A terhelési kapacitás és az életminőség javítása Az exacerbációk gyakoriságának/súlyosságának csökkentése A komplikációk megelőzése és kezelése A halálozás csökkentése /GOLD, Workshop Report 2001/ A COPD komplex kezelése • Prevenció - rizikofaktorok kiküszöbölése (dohányzás!) - immunizálás, immunmoduláció • Farmakoterápia - bronchodilatátorok, antibiotikumok, kortikoszteroidok, mucolitikumok • Oxigén-kezelés (rövid-,hosszú távú) • Gépi lélegeztetés (noninvasíve-NIPPV/invazív) • Műtét ( bullektomia, volumen-redukció, transzplantáció) • Rehabilitáció (légzőtorna,mellkasi fizióterápia,terheléses tréning,diétás tancsadás,psychoszociális támogatás ,betegoktatás) Biztosítja az elérhető optimális funkcionális állapotot • Folyamatos gondozás A COPD prevenciója • A dohányzás és más rizikófaktorok
kiküszöbőlése • • • • Az egyetlen beavatkozás, amely a progresszív légúti funkcióvesztést képes lefékezni (~ 30 %-kal csökkenti az exacerbációk incidenciáját) Évenkénti influenza elleni védőoltás (ősszel, vagy ősszel és télen) 50%-al csökkenti az influenza okozta akut exacerbációkat és a kapcsolatos mortalitást 5-6 évenként polivalens (23 virulens szerotipust tartalmazó) pneumococcus elleni védőoltás ( igazoltan a S. pneumoniae bakteriémiával társult fertőzésekben hatásos). Általános alkalmazásának szükségessége COPD-ben még megerősítésre szorul. Immunmoduláns kezelés, a légutakban leggyakrabban kimutatható 8 baktérium liofilizált kivonatával: Broncho-Vaxom kúraszerű alkalmazása csökkenti az exacerbációk gyakoriságát és a kórházi kezelések számát. Antioxidáns kezelés (N-acetylcystein) kúraszerű alkalmazása csökkenti az exacerbációk súlyosságát. A dohányzásról való leszokás
elősegítése A dohányzás kiiktatása a COPD minden súlyossági fokozatában az egyedüli hatásos - és költséghatékony – kezelés, amely hosszú távon bizonyítottan lassítja a tüdőfunkció progresszív romlását. A dohányzás abbahagyása esetén a nikotin utáni vágy és a megvonási tünetek csökkentésére • nikotinpótló készítmény (rágógumi,bőrtapasz,orrspray,sublingvális tabletta ) ajánlott : a kezelés tartama 6-12 hét a nikotinpótlás lépcsőzetes csökkentésével • antidepresszáns buproprion (Zyban) kezelés 7-12 héten át (2x150 mg/nap) • parciális nikotinreceptor agonista vareniklin (Champix) (12 hetes kezelés, sikeres leszokás esetén egy újabb 12 hetes kúra (2x1 mg/nap) mérlegelendő A stabil COPD farmakoterápiája (általános irányelvek) • A klinikai súlyossághoz illeszkedő lépcsőzetes kezelés • Folyamatos, azonos gyógyszerhatást biztosító terápia mindaddig,amíg a betegség súlyosbodása vagy
mellékhatások a „ fenntartó” kezelés megváltoztatását teszik szükségessé • A betegenként általában eltérő „ terápiás válasz ”- hoz igazított gyógyszerek és gyógyszeradagok alkalmazása A COPD I-IV súlyossági fokozataiban ajánlott fenntartó kezelés (GOLD,2006) I. ENYHE II. KÖZÉPSÚLYOS • FEV1/FVC< 70%* • FEV1/FVC< 70% • FEV1 > 80%* • 50%<FEV1<80%* Intermittáló panaszos Állandó panaszos III. SÚLYOS IV. NAGYON SÚLYOS • FEV1/FVC< 70%* • • FEV1/FVC < 70% • 30%<FEV1<50%* FEV1 < 30 %* vagy < 50 %* + krónikus légzési és/vagy Exacerbációk jobb szívfél-elégtelenség A kockázati tényezők (dohányzás!) kiküszöbölése, influenza vakcináció Rövid hatású hörgőtágítók (anticholinergikum és/vagy β2-agonista) szükség szerint Egy vagy több elhúzódó hatású inhalációs hörgőtágító Légzésrehabilitáció ( + előző lépcső) Inhalációs kortikoszteroid ( +
előző lépcsök ) * Post-bronchodilatátor értékek GOLD Workshop Report 2006 Tartós oxigén-kezelés (krón. légzési elégtelenség esetén) Sebészi kezelés ? ( + előző lépcsők) Hörgőtágítók stabil COPD-ben • A stabil COPD tüneti kezelésében és a komplikációk megelőzésében a bázisterápiát jelentik (A) • A β2-agonisták, az anticholinergikumok és a theophyllin vagy ezek kombinációi közötti választás a gyógyszerek elérhetőségének, a panaszok csökkenésével mérhető individuális hatásuknak és mellékhatásaiknak a függvénye • A tünetek megelőzésére és enyhítésére „szükség szerint” vagy „folytonosan” alkalmazhatók • Az inhalációs terápia előnyösebb, a terápiás hatás/kockázat arányt növeli • A hosszú hatású inhalációs bronchodilatátorok sokkal hatékonyabbak mint a rövid hatású szerek • A különböző támadáspontú és hatástartamú hörgőtágítók kombinált alkalmazása
növeli a terápiás haszon/kockázat arányt (GOLD 2003) Inhalációs β2-agonista és anticholinerg hörgőtágítók COPD-ben Rövid hatású hörgőtágítók − A stabil COPD minden súlyossági lépcsőjén (I-IV) adhatók szükség szerint vagy rendszeresen − Akut exacerbációban ! Hosszú hatású hörgőtágítók A COPD II-III-IV. súlyossági lépcsőjén egy vagy több szer kombináltan,folyamatosan adható Hörgőtágítók COPD-ben β2 agonisták Rövid hatású szerek Salbutamol (Ventolin Evohaler) Terbutalin (Bricanyl Turbuhaler) Fenoterol (Berotec N aerosol) Fenoterol/ipratropium bromid (Berodual N aeroszol) Hosszú hatású szerek Formoterol (Oxis Turbuhaler, Foradil inhalációs kapszula) Salmeterol (Serevent aeroszol, diszkusz) Anticholinerg szerek Rövid hatású szerek: Ipratropium bromid (Atrovent aeroszol) Hosszú hatású szer: Tiotropium bromid (Spiriva inh. kapszula + Handihaler) Hosszú hatású per os theophyllinek β2-agonista
hatások Bronchodilatáció β1 cardiális β2 pulmonális β3 zsirszövet β2-agonisták Plazma exudáció Cholinerg neurotranszmisszió Mucociliaris clearance Neutrofil funkció Baktérium adherencia β2- agonisták terápiás hatásai • Légúti simaizomzat közvetlen ellazítása (funkcionális agonisták) • Hyperinfláció csökkentése • Antiinflammációs hatás − Csökkentik a plazma exsudációt − Gátolják a neutrophilek toborzását,aktiválását − csökkentik a légúti nyálkahártyára tapadó bakrériumok számát • Mucociliaris clearance fokozása Rövid hatásü szerek: gyors hatáskezdet(percek),4-6 órás hatástartam Salbutamol, Terbutalin, Fenoterol Hosszú hatású (~12h) szerek: Formoterol (Oxis),Salmeterol (Serevent) Formoterol: gyors hatáskezdet ( percek),”sürgősségi” hörgőtágító is Hosszú hatású β2-agonista hatások • Prolongált bronchodilatáció (~ 12h),függetlenül a kiváltó oktol • Csökkentik a
dinamikus hyperinflációt • Enyhítik a dyspnoét • Javítják a terhelési toleranciát A tüneti javulás általában > FEV1-javulás • Csökketik az exacerbációk gyakoriságűt különösen súlyos COPD-ben • Javitják az életminőséget • Növelik a mucociliaris clearance-t ( csillók csapási frekvenciáját) Gyulladáscsökkentő hatásuk is van • Csökkentik a plazma exsudációt (a post-capilláris venulák endothelsejtjei közötti rések zárásával, amit gyulladásos mediátorok nyitnak meg) • Gátolják a neutrophilek toborzását és aktivációját (ezt a hatást a kortikoszteroidok fokozzák) Rövid és hosszú távú β2-receptor deszenzitizáció A β2-agonistával történt kapcsolódás hatására a receptor tulajdonságai megválzoznak • Tachyphylaxis a β2-receptor gyors deszenzitizációja A β2-agonistával történő első találkozás alkalmával (vagy fokozott β2-agonista használat esetén) alakul ki. Hátterében a β2-receptor
és a hatását közvetítő Gprotein közötti kapcsolat átmenetileg megszakad („uncoupling”), majd az agonista távozásával visszaáll az eredeti helyzet, azaz a receptor stimulálhatóvá válik. • Tolerancia a β2-receptor hosszú távú deszenzitizációja („downregulation”) Folyamatos β2-agonista hatás esetén a β2-receptorok száma csökken. A jelenség internalizáció néven ismert.Visszaszorul a β2- receptor gén-expresszió is,ami tartós „down-reguláció”-hoz és receptorvesztéshez vezet. (Négy héten át 4x200 mcg inhalációs salbutamol hatására a β2-receptor sűrűség a tüdőkben 22%-kal csökken és csökken a hörgőtágító hatás is.) Szintetikus inhalációs anticholinergikumok* Második generációs, rövid hatású (> 6 h), nem-szelektív (M1=M2=M3) szerek: – Ipratropium bromid – Oxitropium bromid Harmadik generációs, hosszú hatású (> 24 h), szelektív (M3, M1>M2) szer: – Tiotropium bromid (SPIRIVA) * Az
atropin kvaterner ammónium derivátumai, hidrofilitásuk miatt csak minimális mennyiségben (~ 1%) jutnak be a szisztémás keringésbe, így atropinszerű mellékhatásoktól csaknem mentesek. A stabil COPD fenntartó kezelésében elsőként választandó hörgőtágítók. A cholinerg idegaktivitást nikotin (N) és muszkarin (M) receptorok mediálják, a neurotranszmitter az ACh. preganglionalis ideg N (+) ACh kolinerg ganglion M1 (+) postganglionalis ideg M2 (-) ACh M3 (+) simaizom COPD-ben a bronchokonstrikció döntően ACh fokozott felszabadulásával kapcsolatos. Ennek mechanizmusa: – centrálisan mediált vagalis reflex-mechanizmus – az efferens kolinerg idegaktivitás fokozódása – M2 autoreceptorok károsodása Inhalációs anticholinergikumok terápiás hatásai • Csökkentik a fokozott cholinerg simaizomtónust: COPD-ben ez az obstrukció fő reverzibis komponense (hatáserősség 2-agonista) • Protektív hatásuk van
bronchokonstriktoros stimulusokkal szemben • A bronchialis szekrétumot enyhén csökkentik • A mucociliaris clearance-re hatástalanok • Atropinszerű szisztémás mellékhatásaik - eltekintve a szájszárazságtól nincsenek • Tolerancia tartós alkalmazás esetén sem alakul ki • Hatékony bronchodilatátorok nocturnalis, β-blokkolóval indukált,akut • És gyermekkori asthmában, idős betegeknél Tiotropium bromid: szelektív (M3, M1), hosszú hatású, inhalációs antikolinergikum Farmakológiai jellemzők • Receptor-affinitás (10x > ipratropium, M1 = M2 = M3) • Lassú disszociáció az M3 (34.6 óra*)- és M1 (14.6 h*)-receptorokról vs. M2 (36 óra*) • Kinetikus szelektivitás (M3 > M1 > M2) • Kolinerg bronchokonstrikció prolongált gátlása (> 24 óra) • Tartós bronchodilatáció ( 24 óra) • Naponta egyszer alkalmazandó (18 g) hörgőtágító * Receptor-tiotropium komplex felezési ideje A tiotropium bromid*
terápiás értéke • Szelektív M3 -receptor antagonizmus – – – – – – jobb tüdőfunkciós értékek kevesebb klinikai tünet ritkább exacerbáció és hospitalizáció jobb terhelési teljesítmény jobb életminőség nem alakul ki tolerancia • 24 órás hatás – napi egyszeri adagolás – jobb compliance * Első vonalbeli bronchodilatátor a COPD II-IV. súlyossági fokozataiban Theophyllinek • Hörgőtágító hatásuk mérsékelt • Alkalmazásuk COPD-ben korlátozott : alacsony hatás/rizikó arány (nem szelektív mellékhatások, farmakológiai interakciók ) • Anti-inflammációs hatásuk van – neutrophilek számát csökkentik (indukált sputumbam) – gátolják a netrophil kemotaxist Mechanizmus ? – IL-10 termelés növelése ?,adanozin-R antagonizmus ? – HDAC aktivitás növelése ? (gyulladásos gén expressió • A diaphragma kontrakcióját növelik ?) Hosszú hatású theophyllinek • A theophyllin kevésbé hatékony
hörgőtágító COPDben és potenciális toxicitása miatt előnyt élveznek az inhalációs hosszú hatású hörgőtágítók • Terápiás ablakuk szűk,kívánt szérumszintjük: 8-12 µg/mL • Monoterápiában való alkalmazásuk nem ajánlott • Az újabb kezelési irányelvek második, ill. harmadik vonalbeli gyógyszerként ajánlják COPD-ben • Inhalációs β2 agonistával és/vagy anticholinerg szerrel kombinálva additív hatás érhető el Inhalációs kortikoszteroid kezelés stabil COPD-ben Hatékonyságuk enyhe és mérsékelten súlyos stabil COPD-ben bizonytalan, csupán a betegek szűkebb, legfeljebb 10-15 %-át kitevő, asthmás jellemzőket mutató csoportjánál hatásosak. Krónikus kezelés szisztémás szteroidokkal a kedvezőtlen terápiás hatás/kockázat arány miatt kerülendő. Rendszeres inhalációs szteroid kezelés stabil COPD-ben csak tünetes betegeknél javasolt, ha - a post-bronchodilatátor FEV1 (r.é%) <50* 1 - az exacerbációk
gyakoriak (>3/év) (*légúti funkciójavulás hiányában is) *Ezekben az esetekben enyhén mérséklik a légúti funkcióvesztés ütemét, ritkítják az exacerbációkat, enyhítik a panaszokat és javítják az életminőséget Az inhalációs kortikoszteroidok hatása súlyos, stabil COPD-ben enyhén mérséklik a légúti funkcióvesztést csökkentik a panaszokat javítják a terhelhetőséget, életminőséget 25-30%-al csökkentik az exacerbációk számát/súlyosságát csökkentik a kórházi felvételek számát csökkentik a sürgösségi hörgőtágítók használatát hatásuk a mortalitásra ? Inhalációs kortikoszteroidok Beclomethason : Aldecin aeroszol Budesonid Fluticason : Pulmicort turbuhaler,aeroszol : Flixotide diszkusz, aeroszol Kombinációs készítmények Fluticason+salmeterol Seretid diszkusz Budesonid+formoterol Symbicort turbuhaler Hosszú távú (otthoni) oxigén-kezelés indikációi COPD-ben Az indikáció csak stabil
állapotban itélhetö meg, ha az adequat fenntartó gyógyszerelés mellett is konzisztens hypoxaemia áll fenn ( általában a COPD IV.stádiuma) • PaO2 <55 Hgmm (7,3 kPa) vagy a SaO2 < 88% hypercapnia (A) áll fenn,ill. a • PaO2 55-60 Hgmm (7,3-8,0 kPa) közötti vagy a SaO2 < 89 % + pulmonalis hypertonia, perifériás oedema, polycythemia (Htk > 55%) áll fenn (D) Naponta > 15 órás oxigén-kezelés 6-7 évvel nyujtja meg az életet Javítja a haemodinamikát, a pulmonalis hypertensio progresszióját,a hypoxaemia okozta Polycythaemiát,a tüdő mechanikát,a psyches állapotot,az életminőséget Oxigénpótlás. Beállítás:a PaO2 8 kPk ((60-65 Hgmm),a SaO2 90% fölé emelkedjen a PaCO2 < 2.0 kPa (15 Hgmm) emelkedése mellett - palackból orrszondán át,1-3 L/perc - oxigénkoncentrátorból 2-4 L/perc (olcsó,OKPTI engedély szükséges) - cseppfolyós oxigénellátó rendszerek (regionális szakfőorvos engedélyével) „COPD-ben a
farmakoterápia egyik formája sem képes a légúti funkció progresszív csökkenését megállítani” GOLD 2003 Igaz ez a legújabb vizsgálatok tükrében ? A pre-bronchodilatátor FEV1 érték változása egy éves tiotropium,illetve placebo kezelés mellett (Két 1 éves tiotropium–placebo kontrollos vizsgálat utólagos analízise) Mélyponti FEV1 (L) 8–344. nap 1.2 Tiotropium (n = 518) -12.4 mL/év * 1.1 Placebo (n = 328) 1 -58.0 mL/év 0.9 18 Napok 344 A tiotropium a tüdőfunkció progresszív romlását (azaz a kórlefolyást) hosszú távon kedvezően módosítja ? * p = 0.005 tiotropium versus placebo Anzueto és mtsai. Pulm Pharm & Therap 2005 AEffect terhelési tolerancia javulása tiotropium és pulmonális of Tiotropium on the Improvement in rehabilitáció kombinációja hatására COPD-ben Exercise Tolerance Resulting from Rehabilitation Study drug Tiotropium Állóképesség * (min) (min) Endurance time 24 * * Rehabilitáció
Rehabilitation 20 32% 42% 16 16% 12 8 0 2 4 6 * Futószőnyegen gyaloglás (0%-os lejtő) 3x/hét > 30 perc *P<0.05 8 10 12 14 16 18 20 22 24 Kezelés (hetek) Weeks on Treatment Tiotropium Placebo n=47 Casaburi n=44et al. Chest 2005;127:809–817 Casaburi et al. Chest 2005 127: 809 - 817 UPLIFT vizsgálat:Tiotropiummal végzett 4 éves vizsgálat COPD-ben Nemzetközi multicentrikus, randomizált, kettős vak, placebo kontrollált, paralell csoportos vizsgálat, középsúlyos-igen súlyos (az anticholinerg szerek kivételével korábban alkalmazott gyógyszereket használó) COPD-s betegen. Elsődleges végpontok: Pre-bronchodilatátor és post-bronchodilatátor (tiotropium+ rövid hatású anticholinerg+ β2-agonista adása után ) FEV1-érték éves csökkenése a 30. naptól („steady state”), a vizsgálat végéig Másodlagos végpontok: FVC-, IVC- csökkenés üteme,az első exacerbacióig és hospitalizációig eltelt idő, életminőség (SGRQ)
változása, össz-mortalitás Beteg populáció: 8020 betegből 5993 került randomizálásra.A legalább 45 hónapot komplettáló betegek száma 3569 (60%) volt Tashkin D, et al. NEJM 2008 359:1543-1554 UPLIFT : Pre- és post-bronchodilator FEV1 A tiotropium a placebohoz viszonyítva szignifikánsan (p<0.0001) javítja a tüdőfunkciót, (pre- és post-bronchodilatátor FEV1) még a maximális dózisokban alkalmazott salbutamol és ipratropium által elért javuláson túl is. 1,50 Tiotropium * * FEV FEV11(L) (L) 1,40 * * * * Control * 1,30 * * 1,20 * * * * * (n=2516) (n=2374) * * * 1,10 Post-bronch. FEV1 = 47 – 65 mL * (n=2494) (n=2363) 1,00 Pre-Bronch. FEV1 = 87 – 103 mL 0 01 30 nap (steady state) 6 12 18 24 30 36 42 48 Hónapok A tiotropiumot és placebot kapó csoportok között. a FEV1 éves csökkenési ütemében a különbség, sem a pre (30±1 mL)- sem a post-bronchodilatátor (30±1 mL) FEV1 vonatkozásában nem
szignifikáns Pre- és post-bronchodilator FVC Tiotropium 3,30 * * * FVC FVC(L) (L) 3,10 2,90 * * Control † * † † n=2516 Post-Bronch FVC = 32 - 65 mL n=2374 * * * * * * * * 2,70 * n=2494 Pre-Bronch FVC = 170 - 204 mL n=2363 2,50 0 0 1 30 nap (steady state) 6 12 18 24 30 Hónapok 36 42 48 *P<0.0001 vs kontroll †P<0.05 vs kontroll SGRQ Total Score Átlagértékek a mérési időpontokban SGRQ Total Score (Units) Javulás 50 Tiotropium (n = 2478) Control (n = 2337) SGRQ Total Score 45 40 * * 6 12 * * * * 30 36 * * 35 0 0 18 24 Hónapok *P<0.0001 vs kontroll 42 48 = 2.3 – 33 units Probability ofvalószínűsége exacerbation (%) Exacerbatiók (%) COPD exacerbatiók valószínűsége Tiotropium 80 Control 14% rizikó-csökkenés 60 40 Hazard ratio = 0.86, (95% CI, 0.81, 091) 20 p < 0.001 (log-rank test) 0 0 6 12 18 24 30 Hónapok Month 36 42 48
Hospitalizációt igénylő COPD exacerbációk valószínűsége Probability of exacerbation leading Hospitalizációt igénylő COPD to hospitalization (%) exacerbációk valószínűsége (%) Tiotropium Kontroll 40 30 14% rizikó-csökkenés 20 Hazard ratio = 0.86, (95% CI, 0.78, 095) 10 p=0.002 (log-rank test) 0 0 6 12 18 24 30 Hónapok 36 42 48 ICS és LABA kombinációja • A LABA és az ICS együttes alkalmazása a COPD pathofiziológiájának különböző aspektusait befolyásolja (légúti obstrukció, mucociliáris dysfunkció, légúti gyulladás, strukturális változások) • együttes alkalmazás kapcsán pozitív hatások (szinergizmus?): - kifejezettebb hatás érvényesül - segít kivédeni az egyes komponensek negatív hatásait ( ICS csökkenti a ß2- receptorok down regulációját és fokozza a receptor szintézis intenzitását- csökkenti a toleranciakialakulását. LABA ellensúlyozhatja az ICS gyenge légzésfunkciós romlást
befolyásoló hatását) LABA+ICS kombiált kezelés (3 hónap) csökkenti a légúti gyulladás intenzitását középsúlyos/súlyos stabil COPD-ben − Randomizált, kettős-vak, placebóval kontrollált vizsgálat − 67 dohányos vagy ex-dohányos (> 10 pys) stabil COPD-s beteg (GOLD II-III. súlyossági fokozat) − 13 hetes salmeterol+fluticason (2x50/500 µg) kezelés vs. placebo Kezelt csoport versus placebo: − A hörgőbiopsziás mintákban szignifikánsan csökkent a CD45+ -,CD8+ ,CD4+ -,TNF-α-mRNA+ - és a hízósejtek száma − Az indukált köpetben szignifikánsan csökkent (p<0.037) a neutrofil sejtek száma − A CD8+, a TNF-α-mRNA+ és az IFN-ﻻ-mRNA+ sejtek csökkenése között szignifikáns (p<0.001) pozitív összefüggés állt fenn − A gyulladáscsökkentő hatást a légúti funkció jelentős (p<0.001) javulása kísérte Barnes N,et al. AJRCCM 2006 A hosszú hatású β2-agonisták és a kortikoszteroidok kölcsönhatása
β2-agonista hörgőtágító hatás membrán Kortikoszteroidok gyulladáscsökkentő hatás β2 receptor + + kortikoszteroid receptor Fokozzák a kortikoszteroid receptor Fokozzák a β2-receptor gén transzkripcióját, és ily módon a receptor ”up-regulációját”, a transzlokációját a citoplazmából szintézis intenzitását és megfordítják a a hatás helyére, a nukleusba receptor „down-regulációját” TORCH Calverley P,et al. NEJM 2007 356:775-789 Rabe KF. NEJM 2007 356: 851-852 Randomizált betegszám: 6112. A vizsgálatból a placebó ágban (P) 851, a salmeterol ágban (S) 960, a fluticason ágban (F) 947, a salmeterol/fluticason ágban (SFC) 1011 beteg maradt ki. Vizsgálat kérdése: A salmeterol/fluticason kombináció (SFC),a nagy adag inhalációs kortikoszteroid fluticason (F) és az elhúzódó hatású β2 agonista salmeterol (S) külön-külön befolyásolja-e – a placebo ággal összehasonlítva - a mortalitást 3 éven át tartó
kezelés alatt közepesen súlyos és súlyos COPD-ben (med. post-bronchodilatátor FEV1: 44 %, 10 % alatti reverzibilitással) Másodlagos végpontok (post-bronchodilatátor FEV1,tünetek,életminőség,exacerbatiók száma) TORCH : Össz-mortalitás (3 éven át tartó kezelés és megfigyelés alatt, közepesen súlyos és súlyos ( med.FEV1 : 44% ) COPD-ben) Az ICS/LABA kombináció össz-halálozást csökkentő hatása nem bizonyult szignifikánsnak (a statisztikai szignifikancia szintjén maradt) AZ ICS ( fluticason ) önmagában nem ajánlható COPD-ben. A S, ill. az SFC kombináció mortalitást befolyásoló hatása között nincs szignifikáns eltérés 16 (%) 16.0 % 15.2 % Placebo (n=851) Salmeterol (S) 2x50µg (n=960) Fluticason (F) 2x500 µg (n=947) SFC 2x50/500 µg (n=1011) 12 13.5 % 12.6 % 8 4 HR, 0.825 (95% Cl, 0.681-1002) P ( Placebo vs. SCF) = 0052 (long-rank test) 0 0 24 48 72 Hetek 96 120 156 Calverley P,et al. NEJM 2007 356:775-789 Rabe KF.
NEJM 2007 356:851-852 8 TORCH : COPD-vel ősszefüggő halálozás valószínűsége (%) Placebo Salmeterol (S) : 2X50 µg Fluticason (F) : 2X500 µg SF : 2X50/500µg 6 6.9% 6.1% 6.0% 4.7% 4 2 0 0 24 48 72 Hetek 96 120 156 Carverley P,et al. NEJM 2007 356:775-789 Rabe KF. NEJM 2007 356: 51-852 TORCH : Farmakoterápia hatása a tüdőfunkció csökkenésének sebességére középsúlyos, súlyos COPD-ben 1350 Post-bronchodilatátor FEV1 (mL) Placebo Salmeterol (S) : 2X50 µg Fluticason (F) : 2X500 µg SFC : 2X50/500µg 1300 1250 - 39 mL/év P < 0.001 1200 - 42 mL/év - 42 mL/év P < 0.003 1150 Az SCF kombinált-,valamint az S és F kezelés önmagában, szignifikánsan lassítja a légúti funkció romlását placebóhoz képest. Farmakoterápiával a COPD kórfejlődése lassítható. 1100 - 55 mL/év 0 0 24 48 72 Hetek 96 120 156 Celli BR,et al. AJRCCM 2008 178:332-338 TORCH: Összefüggés az egyes terápiás (P,S,F,SFC) hatások
és az évi FEV1 csökkenés között A FEV1-csökkenés a COPD kórfejlődésének megbízható markere. A TORCH vizsgálatban a placebo ágban mért med. FEV1-csökkenés (55mL/év) hasonló volt, mint a Lung Health Study-ban (47 mL/év), a BRONCUS (54mL/év) és ISOLDE (59mL/év) vizsgálatokban. A placebóval kezelt csoporthoz képest a med. évi, postbronchodilatátor FEV1csökkenés a salmeterollal és fluticasonnal kezelt csoportokban átlagosan 13 mL-rel (p < 0.003), a salmeterol / fluticason kombinációval kezelt csoportban 16 mL-re (p < 0.001), szignifikánsan alacsonyabb volt Az aktív kezelés jelentősen mérsékelte a meredek légúti funkció-romlást. Ennek hátterében a hyperinfláció,a légúti gyulladás csökkenése és a mucociliaris clearance javulása egyaránt állhat. A vizsgálat bizonyítékot szolgáltatott arra,hogy farmakoterápiával a COPD kórfejlődése sikerrel befolyásolható. Hatásos, kombinált, fenntartó kezelés (a COPD akut
exacerbációinak megelőzése) - LABA+LAMA kombináció - LABA+ ICS kombináció - LABA és LAMA + ICS kombináció - LABA és LAMA + ICS (+ teofillin?/+PD-4 gátlók?) LABA: elhúzódó hatású ß2-agonista aeroszol LAMA: elhúzódó hatású atikolinerg aeroszol ICS: inhalációs kortikoszteroid. PD4-gátlók: foszfodiészteráz4-gátlók A COPD akut execerbációjának kezelése A COPD klinikai lefolyása COPD Kilégzési áramláskorlátozottság Exacerbációk AIR TRAPPING Hiperinfláció Légszomj Dekondicionálodás − Optimalizálja a kilégzési áramlás generálását − Súlyos restriktív mechanikai deficitet eredményez Inaktivitás Csökkent terhelhetőség Csökkent életminőség Rokkantság Betegség progressziója Halál A COPD akut exacerbációi • A lokális és szisztémás gyulladás, valamint a klinikai tünetek akut fokozódásával járó elhúzódó epizódok • Gyakoriságuk a COPD fenotípusától („bronchitiszes” B-típusú
COPD-ben szenvedők fogékonyabbak infekciókkal szemben) és súlyosságától függ • A kezelés módosítását, gyakran kórházi ellátást tesznek szükségessé • Gyakoriságukkal és súlyosságukkal nő a rövd távú mortalitás ( 0.75 L alatti FEV1 esetén az 1 és 10 éven belüli halálozás 30-ill. 90%) és romlik a túlélők funkcionális állapota és életminősége A 2006-os GOLD-ajánlás tünet/esemény alapú definiciója „ a COPD exacerbációját a betegség természetes lefolyását megszakító eseményként definiálja, amelyet a beteg bazális tüneteiben (nehézlégzés,köhögés és/vagy köpetürítés) bekövetkező olyan mértékű változás (romlás) jellemez, amely meghaladja az egyébként előforduló naponkénti változások mértékét, akutan lép fel és változtatást igényel a beteg szokványos kezelésében ” A tüdőfunkció ingadozása COPD-ben Légúti funkció Légúti funkció a stabil klinikai állapot
„normális” ingadozása „exacerbáció” szintjét elérő állapotromlás Idő Idő COPD exacerbáció Anthonisen: tünet-alapú definíció és súlyossági besorolás Major tünetek (Winnipeg kritériumok) Tünet-alapú súlyosság: • fokozódó dyspnoe • fokozódó köpetmennyiség • purulencia megjelenése,fokozódása 1.típus: 3 major tünet * 2.típus: 2 major tünet 3.típus: 1 major + 2 minor tünet ± Minor tünetek: torokfájdalom a megelőző 5 napban, orrfolyás, fokozodó zihálás, mellkasi feszülés, más okkal nem magyarázható láz, új röntgen-eltérés, szív/légzési frekvencia > 20%-os növekedése, leukocitózis *antibiotikus kezelés ajánlott, szignifikáns előnyökkel jár Anthonisen NR, Ann Intern Med 1987 Minél súlyosabb a COPD, annál gyakoribbak az exacerbációk. Burge PS és mtsai: the ISOLDE TRAYEL BMJ 2000: 320: 1297-1303 * COPD (II-IV) = az akut exacerbációk átlagos gyakorisága 3/év (1- 8 exacerbáció)
és ezek felében nem fordulnak orvosi segitségért. Seemungal TAR,et al. AJRCCM 1998 157: 1418-1422 A COPD exacerbációk hatásai • • • • • • Fokozzák a tüneteket Csökkentik a tüdőfunkciót Rontják az életminőséget Növelik a mortalitást Gyakoribb exacerbációk – gyorsabb FEV1 csökkenés A felépülés után a betegség progressziója felgyorsul Seemungal et al. AJRCCM 1998/2000 Donaldson et al. Thorax 2002 Fan et al. Chest 2002 A COPD akut exacerbációja Mortalitás Kórházi kezelést igénylő súlyos esetekben: 3-10% Intenzív légzésterápiát igénylő esetekben (65 évesnél idősebbek esetében): >30% A COPD exacrbációja miatta halálozás rizikoját a respiratorikus acidózis, bizonyos társbetegségek megléte, és a lélegeztetés szükségessége határozza meg. Az akut exacerbáció súlyosságának megítélése Az exacerbációt megelőző kórtörténet áttekintése • A stabil állapot súlyosságnak
megítélése,FEV1- érték • A korábbi exacerbációk gyakorisága,súlyossága/hospitalizációk szükségessége • Az újonnan megjelent tünetek intenzitása,tartama • Korábbi fenntartó kezelés A súlyosság jegyei • Légzési segédizmok használata • Paradox mellkasfal-mozgás • Centrális cyanosis kialakulása/mélyülése • Perifériás oedéma kialakulása • Haemodinamikai instabilitás • Jobb szívfél-elégtelenség jelei ( juguláris vénás nyomás, tapintható máj, oedema) • Csökkent éberségi szint, zavart tudat COPD akut exacerbáció: kórházi felvétel indikációi • A tünetek intenzitásának markáns változása (pl.hirtelen fokozódó nyugalmi nehézlégzés) • Súlyos stabil COPD (mint alap) • A beteg állapota a megkezdett rohamoldó kezelésre nem javul • Újonnan megjelenő fizikális jelek (cyanosis,perifériás oedema) • Szignifikáns társbetegségek • Gyakori exacerbációk • Újonnan kialakult arrythmiák •
Diagnosztikus bizonytalanság • Idős (65 év feletti) kor A COPD akut exacerbációjának kezelése A fenntartó kezelés módosítása • Rövid hatású,inhalációs hörgőtágító kezelés (dózis/alkalmazási gyakoriság emelése) • Rövid tartamú (10-14 nap) orális/parenterális kortikoszteroid kezelés • Antibiotikus kezelés : fokozódó dyspnoe,fokozódó mennyiségű,purulens köpet esetén (B evidencia) Indikációk fennállása • Rövid távú,kontrollált oxigén kezelés esetén • Nem invazív pozitív nyomású gépi lélegeztetés (NIPPV) * * Antibiotikus kezelés • Invazív gépi lélegeztetés * (B evidencia) • Folyadékháztartás monitorozása,táplálás • Antikoaguláns kezelés mérlegelése (embolisatio esetén) • Komplikációk,szövődmények kezelése: a súlyos tünetek hátterében pneumonia, tüdőembólia, ptx, balkamra-elégtelenség, felborult cukoranyagcsere, progrediáló carcinoma állhat GOLD 2006 A COPD akut
exacerbációjának kezelése • Rövid hatású inhalációs hörgőtágitó kezelés (adagoló aeroszol + toldalék, levegő-hajtású kompresszoros porlasztó) A fenntartó hörgőtágító kezelés módosítása szükséges (adag/adagolás gyakoriság növelése)) – β2-agonista* aeroszolból maximum 300-400 µg 1-2 óránként – anticholinerg aeroszol (ipratropium) 60-80 µg 3-4 óránként • 10-14 napon át orális/parenterális kortikoszteroid kezelés ( metilprednizolon 40 mg /nap). *Az ajánlott hörgőtágító akut exacerbációban.Ha β2 agonistával gyors légúti hatás nem jelentkezik, akkor anticholinerg aeroszollal kiegészítés Az akut exacerbációk kezelése porlasztott hörgőtágítókkal • Ventolin (salbutamol) oldat (0.5%) 0.5mL* (2.5-50 mg) naponta 4X • Berotec (fenoterol) oldat (0.1%) 0.5-10 mL* (2.5-50 mg) naponta 4X • Atrovent (ipratropium bromid) oldat (0.025%) 1-2 mL* (0.25-05 mg) naponta 4X • Berodual oldat (ipratropium 0.025%
+ fenoterol 005%) 1-2 mL* (0.25-05 mg ipratropium + 05-10 mg fenoterol) naponta 4X A hörgőtágító aeroszol kezelést kompresszoros porlasztóval célszerű végezni, általában 4-6 óránként. 100%-os oxigénnel hajtott porlasztok alkalmazása respirációs acidózisban ellenjavallt * 2-4mL fiziológiás sóoldatban hígítva A COPD akut exacerbációinak antibiotikus kezelése Az enyhe esetek spontán gyógyhajlama jó Antibiotikus kezelés az akut exacerbációk súlyos eseteiben indokolt • ha az infekció mindhárom major tünete (fozódó mennyiségű köpet-ürítés,a köpet purulencia fokozódása, fokozódó dyspnoe) fennáll (B evidencia) • ha a beteg idős, kis légzési tartalékkal rendelkezik, társbetegségekben szenved (pangásos szívelégtelenség hipertonia,stb.),akinél évente legalább 3-4 exacerbáció jelentkezik és gyakran kényszerül orális szteroid kezelésre (10-30 %-uk intenzív légzéstámogatásra szorul) Cél: Az infekció gyors
leküzdése (baktérium eradikáció,baktérium koncentráció csökkentése), a szövődmények megelőzése Rövid távú kontrollált oxigén-kezelés (A sürgősségi ellátás első lépése) Indikációk: • PaO2< 55 Hgmm (7,3 kPa) vagy a SaO2< 88% hypercapnia (A) • PaO2 55-60 Hgmm (7,3-8,0 kPa) vagy SaO2 89 % + pulmonalis hypertonia, perifériás oedema, polycythemia (Htk > 55%) (D) Rövid távú oxigén-kezelés algoritmusa akut exacerbációban* PaO2 < 60 Hgmm (8.0 kPa) (szobalevegőn) O2-kezelés kezdeti FIO2 24% Kontroll 30-60 min között Javulás PaO2 > 60 Hgmm Javulás nem megfelelő FI,O 2 lépcsőzetesen Kontroll 30 min-ként Kontroll 4 óránként FIO2 24% PaO 2 > 60 Hgmm,stabilan Kontroll 4 óránként PaCO2 : < 10 Hgmm PaO2 > 60 Hgmm stabilan Éberség csökkenése PaO2 < 40 Hgmm (5.3kPa) PaCO2 >60 Hgmm (8.0kPa) vagy pH < 7.25 FI,O 2 > 40%+ NIPPV mellett FIO2 lépcsőzetes Kontroll 4 óránként LTOT
mérlegelése ITO A COPD akut exacerbációinak leggyakoribb kórokozói Csoport/ definició A. Enyhe exacerbáció: a kimenetelt rontó tényező * nélkül Leggyakoribb kórokozók • H.influenzae • S.pneumoniae • M.catarrhalis • C.pneumoniae • Virusok B. Mérsékelten súlyos exacerbáció A csoport + a kimenetelt rontó tényezővel • Penicillin rezisztens S.pneumoniae • Enterobacteriaceae (K.pneumoniae, E.coli,Proteus,etc) C. Súlyos exacerbáció P.aeruginosa veszélye mellett B csoport + • P.aeruginosa * Kisérő betegségek, súlyos COPD, >3 exacerbáció/év,antibiotikus kezelés 3 hónapon belül A COPD akut exacerbációja súlyossági fokozatai szerint ajánlott antibiotikus kezelés(GOLD,2006) Súlyossági csoport A. Enyhe exacerbació B. Mérsékelten súlyos exacerbáció C. Súlyos exacerbáció Oralis kezelés Egy cardinalis tünet* esetén antibiotikum nem szükséges, ha mégis,akkor β laktám,tetracyclin trimetoprim/sulfametyasol
β laktám/β laktamáz inhibitor Alternatív oralis kezelés Parenteralis kezelés β lactam/β lactamáz inhibitor Makrolidok Cephalospor. (ii-iii) Ketolidek ( telitromycin) Respirációs fluorokinolonok β laktám/β laktamáz inhibitor (Co-amoxclav) Ampicillin/Sulbactam Cephalospor.(II III) Fluorokinolonok (Levo-Moxifloxacin) Fluorokinolonok (Cipro-levofloxacin) β laktám P.aeruginosa aktivitással A non-invazív pozitív nyomású gépi lélegeztetés (NIPPV) indikációja a COPD akut exacerbációjában Az alábbi kritériumok közül legalább kettő fennállása • Középsúlyos/súlyos dyspnoe, a légzési segédizmok használata,paradox abdominális mozgás • Középsúlyos/súlyos acidózis (pH: 7.3-735) és hypercapnia (PaCO2 > 45 Hgmm, 6.0 kPa) • Légzési frekvencia > 25/min A non-invazív pozitív nyomású gépi lélegeztetés (NIPPV) a COPD akut exacerbációjában • • • • • a pH emelkedik a dyspnoe csökken a PaCO2 csőkken a
kórházi mortalitás csökken az intubáció és kontrollált gépi lélegeztetés gyakorisága csökken (az esetek 80-85%-ában az intervenció sikeres) Az invazív gépi lélegeztetés indikációi a COPD akut exacerbációjában • NIPPV hatástalanság esetén: a beteg nem tolerálja vagy nem alkalmas a noninvazív intermittáló légzéstámogatásra • Súlyos dyspnoe,légzési segédizmok használata,paradox hasi mozgás • Légzési frekvencia > 35/min • PaO2 < 40 Hgmm, PaCO2 > 60 Hgmm (8.0 kPa), pH < 725 • Aluszékonyság,tudatzavar • Cardiovascolaris komplikációk (hypotensio,shock,szívelégtelenség) • Sepsis,pneumonia,pulmonalis embolisatio,stb. • Légzésleállás • Egyéb komplikációk (pneumonia, tüdőembolisatio.sepsis, stb) Köszönöm a figyelmet ! Kortikoszteroid rezisztencia COPD-ben Teofillin (< 10 mg · L-1) Antioxidánsok? NO szintetáz inhibitorok? Cigarettafüst Oxidatív stressz Peroxinitritek Ө HDAC
inhibitor trichostatin Kortikoszteroidok? Hiszton deacetiláz (HDAC) aktivitás csökken * Hiszton acetiltranszferáz aktivitás - Gyulladásos gének (IL-8,TNF-α,etc.) expressziója nő * Bazális aktivitása COPD-s dohányosokban < mint „normál” dohányosokban COPD: akut exacerbáció (Az exacerbáció és súlyosságának standardizált definiálása hiányzik) Tüneteken alapuló definició: • Anthonisen N (1987) • Rodriguez-Roisin N (2000) Az egészségügyi ellátás (terápia/beavatkozás) igénybevételének szükségességén alapúló definició: • Enyhe exacerbáció: a szokásos terápia módosítását (adag/adagolás gyakoriság növelését) teszi szükségessé • Középsúlyos exacerbáció: Antibiotikum és/vagy orális alkalmazását teszi szükségessé • Kórházi ellátást igényel kortikoszteroid A COPD exacerbációja Konszenzus definíció: „a beteg állapotának elhúzódó rosszabbodása, amely a stabil
klinikai állapot „normál” naponkénti ingadozásának mértékét meghaladja, akutan lép fel és az alapbetegség fenntartó kezelésének megváltoztatását teszi szükségessé” Fokozatai (az egészségügyi ellátás igénybevétélének szükségessége alapján): Enyhe exacerbáció: a szokásos terápia változtatását,az akalmazott szerek dózisának emelését igényli Középsúlyos exacerbáció: antibiotikum és/vagy szteroid bevezetése szükséges Súlyos exacerbáció: kórházi ellátás szükséges Rodriguez-Roisin R. Chest, 2000 A COPD exacerbációinak következményei Emelkedett mortalitás az exacerbációk hospitalizációjával Csökkent egészségfüggő életminőség Exacerbációk FEV1 gyorsult csökkenése Az egészségügyi források fokozott igénybevétele, magasabb közvetlen költségek Az exacerbációk gyakoriságának hatása a légúti funkcióvsztés Exacerbations and FEV in the 1 decline (FEV1- csökkenés) ütemére az „
East London Study”-ban East London Study 0.95 Nem gyakori exacerbációk (< 3/év): Infrequent med.FEVexacerbators 1- csökkenés 32 mL/év FEV1 (L) Az 0.90 exacerbációk gyakoriságának hatása a FEV1 csökkenésére COPD-ben 0.85 0.80 (East London Gyakori exacerbációk (>Study) 3/év): Frequent med.FEV exacerbators 1 csökkenés 40 mL/év 0.75 0 1 2 3 4 Évek Years Donaldson et al. Thorax 2002;57:847–852 Elhúzódó gyógyulás exacerbáció(k) után COPD-ben : HRQL SGRQ total score Exacerbation(s) follow up Egy második during exacerbáció a (n=133) 6 hónapos 60 No further exacerbations (n=299) Exaccerbáció-mentesség a követés követés alatt (n=133) alatt (n=299) • Kezdeti gyors javulás 55 Romlás • Lassúbb hosszú-távú gyógyulás elhúzódó hatással az egészségre 50 45 • Egy második exacerbáció 6 hónapon belül szignifikánsan (p<0.006) lassítja a gyógyulást 40 35 30 Presentation Prezentáció 4 weeks 4
hét 12 12weeks hét 2626 weeks hét Spencer S, et al. Thorax 2003;58:589–593 Az akut exacerbációk megelőzése A ß2-receptor agonisták kombinált alkalmazása COPD-ben (GOLD 2003) • A hosszú hatású ß2- agonisták inhalativ szteroiddal való kombinációja, hatásosabb, mint az egyes szerek önmagukban. (A bizonyíték) ICS+LABA kombinációs kezelés gyulladáscsökkentő hatása stabil (GOLD II-III. fokozat) COPD-ben Javulás Placebo Javulás SALM/FP Bronchialis biopsziás anyag ΔFEV1 (L) SALM/FP 50/500 vs.Placebo Hetek . Barnes N, et al 2006 AJRCCM VA exacerbációs vizsgálat Exacerbációk/betegév exacerbációs napok / Exacerbációs napok/ betegév betegév 1.2 18 1 16 14 0.8 12 0.6 10 8 0.4 6 4 0.2 2 00 19% csökkenés 18 21% csökkenés 14 12 p<0.05 1.05 1.05 0.85 6 0.85 p<0.05 16.0 16.0 12.6 12.6 Placebo Tiotropium 2 0 Placebo Placebo Tiotropium Tiotropium Niewoehner és mtsai. Ann Intern Med (2005)
MISTRAL: az exacerbációk száma 3 Tiotropium (n=497) 34% csökkenés* Placebo (n=506) Exacerbáció/év 2.5 35% csökkenés* 2 1.5 1 0.5 0 Összes exacerbáció *p<0.01 Mérsékelt vagy súlyos exacerbáció A kombinációs kezelés (LABA+ICS) megnyújtja az első exacerbációig eltelt időt Symbicort 254 Budesonide 178 Formoterol 154 Placebo 96 0 100 200 300 Az első exacerbációig eltelt napok számtani közepe Calverley PM, et al. Eur Respir J 2003;22:912–919 Symbicort csökkenti az orvosi beavatkozást igénylő exacerbációk számát Átlagos exacerbáció szám/ beteg/év Szafranski 2.0 Calverley 1.9 1.9 2.0 1.8 1.8 1.6 1.4 1.8 1.8 * 1.6 1.6 1.4 1.4 1.4 1.2 1.2 1.0 1.0 0.8 0.8 0.6 0.6 0.4 0.4 0.2 0.2 0 0 Symbicort Budesonid * 1.6 Formoterol Placebo *p<0.05 vs placebo; p=0.043 Symbicort vs formoterol Szafranski W, et al. Eur Respir J 2003;21:74–81 Calverley PM, et al. Eur Respir J 2003; 22: 912-919
Symbicort Budesonid Formoterol *p<0.05 vs placebo; p=0.015 Symbicort vs formoterol Placebo A kombinációs kezelés javítja az életminőséget (SGRQ total score) Átlagos SGRQ total score Szafranski csökkenés vs placebo Symbicort Budesonide Formoterol Calverley Symbicort 0 0 -1 -1 -2 -2 -1.9 -3 -3 -4 -4 -5 -3.9 -3.5 * * -6 -7 -8 Budesonide Formoterol -3.0 * -4.1 * -5 -6 *p<0.01 vs placebo *p<0.05 vs placebo A beteg szempontjából releváns, klinikailag is mérvadó változás Szafranski W, et al. Eur Respir J 2003;21:74–81 Calverley PM, et al. Eur Respir J 2003; 22: 912-919 -7 -8 *p<0.001 vs placebo -7.5 *p<0.01 vs placebo * *p<0.05 vs placebo; p=0.014 Symbicort vs formoterol; p=0.001 Symbicort vs budesonide A kombinációs kezelés csökkenti a rohamoldó 2-agonista használat mértékét Átl. különbség rohamoldó használat számban/ 24 h a komb. kezelés előtti időszakhoz képest vs. placebo Symbicort
Szafranski Calverley Symbicort Budesonide Formoterol 0 Budesonide Formoterol 0 0.0 -0.5 -0.4 -0.5 * -0.6 * -0.8 -1 -1 * -1.2 -1.3 -1.5 * * *p0.001 vs placebo; p<0.001 Symbicort vs budesonide Szafranski W, et al. Eur Respir J 2003;21:74–81 Calverley PM, et al. Eur Respir J 2003; 22: 912-919 -1.5 *p<0.001 vs placebo; *p<0.01 vs placebo; p<0.001 Symbicort vs budesonide; p=0.032 Symbicort vs formoterol Symbicort csökkenti az orvosi beavatkozást igénylő exacerbációk arányát Exacerbációk aránya vs placebo (%) Symbicort Szafranski Budesonid Calverley Formoterol 0 Symbicort Budesonid 5 Formoterol +3% 0 -2% -5 -5 -10 -10 -15 -15 -12% -15% -20 -20 -25 * -30 -25 -24% *p<0.05 vs placebo; p=0.043 Symbicort vs formoterol Szafranski W, et al. Eur Respir J 2003;21:74–81 Calverley PM, et al. Eur Respir J 2003; 22: 912-919 -24% * -30 *p<0.05 vs placebo; p=0.015 Symbicort vs formoterol A betegség
progressziójának hipotetikus modellje COPD-ben A betegség progressziója 100 75 Exac 50 Rokkantság 25 Halál 0 0 25 50 Életkor (évek) 75 Napi med.PEF (bazális %) A PEF változása exacerbáció alatt 101 100 99 98 97 96 95 -14 -7 0 7 14 21 28 Napok Seemungal et al, AJRCCM 2000 Az exacerbáció hatása a COPD progressziójának ütemére A betegség progressziója 100 75 Exac 50 Rokkantság 25 Halál 0 0 25 50 Életkor (évek) 75 A COPD exacerbációinak infekciós eredete A krónikus bronchitis exacerbációinak 80%-a infekciós eredetű*: 40-50%-ban baktériumok (Haemophylus influenzae, Moraxella catarrhalis, Streptococcus pneumoniae) 30%-ban vírusok (influenza, RSV) 5-10%-ban atípusos baktériumok (Chlamydia pneumoniae, Mycoplasma pneumoniae) Az esetek 5-10%-ában egynél több patogén okozza az exacerbációt (B evidencia) * A súlyos exacerbációk ~ 1/3-ában a kiváltó ok nem identifikákható Sethi S. : Chest 2000: 117: 380S-385S
Β2-receptor deszenzitizáció a β2-agonista β2-receptor Ciklikus AMP IL-1β AMP Kortikoszteroidok β2-R / agonista tartós kötődés GRK-2 (G-protein receptor kináz-2) aktiváció 2-R/Gs-protein szétkapcsolás AC aktiváció és 2-agonista hatás elmarad. A deszenzitizációt gyulladásos stimulusok (pl IL-1) fokozzák, míg a kortikoszteroidok visszafordítják. 2-agonista / kortikoszteroid interakció β2-agonista expozíció cAMP-szint nő PKA aktiválódik a szteroid receptorok közvetlenül vagy közvetve (MAPK aktiváció) áthelyeződnek a nucleusba Az exacerbációk differenciáldiagnózisa • Pneumonia • Tüdőembolia • Congestív szívelégtelenség • Pneumothorax • Pleuralis folyadékgyülem • Arrythmiák • Nem kontrllált tünetekkel járó stabil COPD Egy éves tiotropium kezelés hatása a tüdőfunkcióra COPD-ben (vs. Placebo) 1. nap 8. nap 92. nap FEV1 (L) 1.3 344. nap Tiotropium (n=518) 1.2 1.1
1.0 Placebo (n=328) 0.9 -60 -5 30 60 120 180 Idő (perc) Casaburi R et al. Eur Respir J (2002) Különbség a 28. napon ( T – P, mL) A spirometriás paraméterek javulása 28 napos tiotropium kezelés hatására placebóhoz képest Tiotropium előtt (pre-bronchodilatátor) 600 * (post-bronchodilatátor) * * 400 200 Tiotropium után * * * 0 -200 -400 -600 -800 * FEV1 FVC Áramlás IC * TGV Térfogat *P<0.01, *P<0.001 versus placebo Celli B et al. Chest 2003 124:1743-1749 Az életminőség (SGRQ score) javulása egy éves tiotropium kezelés alatt COPD-ben (vs. Ipratropium) Ipratropium (n=159) 46 Tiotropium (n=327) 44 T-I 3,3 42 * Javulás SGRQ score Bazális * 40 * * 38 *p<0,05 *p<0,01 8 50 92 182 273 364 Napok Vincken W et al. Eur REspir J (2002) Exacerbációk száma/beteg/év Egy éves tiotropium kezelés hatása az exacerbációk incidenciájára COPD-ben (vs. Placebo) p=0,045 1,2 1,0 0,95 20% 0,8 0,76
0,6 0,4 0,2 0,0 Placebo (n=371) Tiotropium (n=550) Casaburi R et al. Eur Respir J (2002) Hospitalizációk száma/beteg/év Egy éves tiotropium kezelés hatása COPD-ben az exacerbációk miatti hospitalizációra (vs. Placebo) p=0,019 0,20 0,16 44% 0,15 0,09 0,10 0,05 0,00 Placebo (n=371) Tiotropium (n=550) Casaburi R et al. Eur Respir J (2002) Antibiotikum-választás a COPD akut exacerbációjában Klinikai állapot Patogének Antibiotikumok I.stádium Enyhe M.catarrhalis S.pneumoniae (penicillin/makrolid rezisztens) aminopenicillin/klavulánsav ampicillin/sulbactam II.,IIIgen cefalosporinok új makrolidok II.stádium Középsúlyos „ „ (penicillin/makrolid rezisztens) vagy respirációs kinolonok? III.stádium Súlyos „ + penicillin +makrolid rezisztens pneumococcusok IV.stádium Nagyon súlyos „ + Gram negatív bélbaktériumok „ vagy respirációs kinolonok respirációs kinolonok (pseudomonas aeruginosa infekció esetén
ciprofloxacin) Antibiotikum-választás a COPD akut exacerbációjában Klinikai állapot Patogének Antibiotikumok I.stádium Enyhe M.catarrhalis S.pneumoniae (penicillin/makrolid rezisztens) aminopenicillin/klavulánsav ampicillin/sulbactam II.,IIIgen cefalosporinok új makrolidok II.stádium Középsúlyos „ „ (penicillin/makrolid rezisztens) vagy respirációs kinolonok? III.stádium Súlyos „ + penicillin +makrolid rezisztens pneumococcusok IV.stádium Nagyon súlyos „ + Gram negatív bélbaktériumok „ vagy respirációs kinolonok respirációs kinolonok (pseudomonas aeruginosa infekció esetén ciprofloxacin) ICS+LABA kombinációs kezelés gyulladáscsökkentő hatása stabil (GOLD II-III. fokozat) COPD-ben Javulás Placebo Javulás SALM/FP Bronchialis biopsziás anyag ΔFEV1 (L) SALM/FP 50/500 vs.Placebo Hetek . Barnes N, et al 2006 AJRCCM Előrelépés a COPD kezelésében Új, a túlélést javító terápiás módok bevezetése
szükséges : − Az exacerbációk hatásosabb megelőzése és kezelése − Hatékonyabb dohányzást felfüggesztő stratégiák − Gyulladáscsökkentő, célzott (a betegség valamennyi komponensére ható) farmakóterápia − Nem farmakóterápiás kezelések ( pulmonális rehabilitáció, non-invazív lélegeztetés) beépítése az egész életen át tartó kezelésbe Az oxigén-kezelés rizikója COPD-ben CO2-retenció (akut COPD-ben gyakoribb) mechanizmusai • CO2-vel szembeni szenzititivitás csökkenése/hiánya (a ventiláció hajtóereje ilyenkor a hypoxaemia) • Hypoxiás vasoconstrictio csökkenése − a véráramlás (Q) az alacsony V/Q rátájú régiokban (funkcionáli shunt) − a véráramlás (Q) ↓ a magas V/Q rátájú régiókban Absorpciós atelektázia Oxigén-toxicitás Ha az FI,O2 35-40% a CO2-retenció ritka Egészségi állapot Az egészségi állapot megállapítását kérdőívek standardizálják. Ezek alkalmasak betegcsoportoknál
a javulás monitorozására terápiás intervenciók (pl. farmakoterápia) vagy pulmonalis rehabilitáció esetén A COPD kezelésének egyik célja a az egészségi állapot javítása, ami a tünetek csökkenéséből, a terhelési tolerancia növekedéséből ,az exacerbációk csökkenéséből, az alvásminőség javulásából következik
200599: 670-682 • Carcinoma A definiált elemek egy entitásként (COPD) foglalhatók össze Krónikus bronchitis Obstruktív bronchiolitis COPD Szisztémás gyulladásos hatások Emphysema • A COPD eltérő kórfejlődésű elemei [krónikus bronchitis, obstruktiv bronchiolitis, emphysema, extrapulmonalis (szisztémás) gyulladásos hatások] általában egymással társulva, gyakran jelentősebb interindividuális különbségekkel járulnak hozzá a COPD patofiziológiájához és tüneteihez úgy, hogy egy adott betegnél a légúti („bronchitises”) vagy parenchymás („emphysemás”) elemek döminanciája feltűnő lehet. • Az egyes elemek önálló entitásként is előfordulhatnak, de a COPD valóban tisztán „bronchitiszes” („B”- típusú COPD) -,vagy „emphysemás” („A”- típusú COPD) fenotípusai inkább csak kivételek. Centrilobularis (centriacinaris) (A,B) és panlobularis (panacinaris) emphysema (C,D) COPD-ben A Konfluáló resp.
bronchiolusok (RB1,2,3) az acinus centrumában C C Alveolusok diffúz destrukciója és összeolvadása az acinusban B D D A súlyos emphysema klinikai fenotípusai „Pink puffer” „Emphysemás”(A)-Tipus „Blue bloater” „Bronchitiszes” (B)-Tipus COPD: definició A Global Initiative for Chronic Obstructive Lung Disease (GOLD,2006) meghatározása szerint: „ A COPD (Chronic Obstructive Pulmonary Disease) olyan kórállapot, amelyet nem teljesen reverzibilis kilégzési áramláskorlátozottság jellemez. Az áramláskorlátozottság általában progresszív és a tüdők abnormális gyulladásos reakciójával kapcsolatos, melyet toxikus részecskék vagy gázok ( főleg dohányfüst) krónikus belégzése vált ki. A COPD megelőzhető és kezelhető betegség, számos szignifikáns extrapulmonalis (szisztémás) hatással, melyek hozzájárulnak a betegség pulmonalis hatásaihoz és súlyosságához”. A COPD alapvető patofiziológiai jellemzői A
krónikus, progresszív, nem teljesen reverzibilis vagy irreverzibilis Kilégzési áramláskorlátozottság kilégzési hajtónyomás (parenchyma) áramlási ellenállás (kis légutak) Air trapping Dinamikus hyperinfláció Air trapping és dinamikus hyperinfláció COPD-ben Kilégzési áramláskorlátozottság Az áramláskorlátozottság növekedésével a tüdők kiürülése lassul: a kilégzési fázis nem teszi lehetővé a komplett kilégzést a respiratorikus rendszer (mellkasfal-tüdő) statikus (relaxációs) térfogat szintjéig (a belégzett levegő egy része ”fogva marad” a tüdőkben) Air trapping • optimalizálja a kilégzési áramlás generálását • súlyos restriktív mechanikai deficitet eredményez Krónikus dinamikus hyperinfláció (részlegesen reverzibilis) Légzési frekvencia növekedése (pl. terhelés, AE, PaO2 ) Air trapping akut fokozódása Akut dinamikus hyperinfláció (dominálóan reverzibilis) A kilégzési
áramláskorlátozottság mechanizmusai COPD-ben Kis légutak (obstruktív bronchiolitis) • A falak gyulladásos strukturális átépülése, megvastagodása a lumen rovására (remodeling), fibrosisa(fixált szükületek), simaizom hyperplasia • Fokozott paraszimpatikus aktivitás • (simaizom konstrikció) • Falstabilitás elvesztése Surfactant „Kipányvázottság” • Luminalis okklúzió Légúti áramlási ellenállás Parenchyma (emphysema) Alveolaris falpusztulás • - alveoláris”kötődések”destrukciója • - elasztikus összehúzó erő csökken • - perifériás légterek nőnek • Capillaris hálózat pusztulása Kilégzési hajtónyomás Kilégzési áramláskorlátozottság A COPD progressziójával (GOLD III/IV.stádium) a perifériás légutak lumenében a gyulladásos mucosus exsudátum volumene szignifikánsan nő Hogg JC,et al. NEJM 2004350:2645-2653 A B Lumen Luminális tartalom Fal A. Perifériás légút nagyon
súlyos B. Ugyanazon légút digitális tükörkép (GOLD IV.stádium) COPD-s beteg manipulációval rekonstruált diagramja teljes kollapszus alatt fixált tüdejéből G • a lumen teljes expandálása után A gyulladás jellemzői (hasonlóságok és különbségek) COPD-ben és asthma bronchiale COPD Gyulladásos sejtek Asthma bronchiale Neutrophilek +++ Macrophagok +++ Tc1 (CD8+) T-sejtek ++ Th1 (CD4+) T-sejtek + B-lymphocyták + Eosinophilek ++ Macrophagok+ Hízósejtek Th2 (CD4+) T-sejtek IL-8, TNF-α, GRO-α, IL-6 IL-1β, NO +, LTB4 Oxidatív stressz +++ IL-4, IL-5, IL-13, Eotaxin RANTES, LTB4, NO +++ Oxidatív stressz + Gyulladás helye Perifériás légutak, Parenchyma, Tüdőerek Főleg a nagy légutak Gyulladásos hatások Laphám-metaplasia, Nyákpangás Kislégúti fibrosis Parenchymapusztulás Vascularis remodeling Epithel denudatio Bazális membrán megvastagodás Terápiás válasz Gyenge hörgőtágító és kortikoszteroid-hatás Kifejezett
hörgőtágító és kortikoszteroid-hatás Mediátork A COPD diagnosztikája Vastag Endre Semmelweis Egyetem Pulmonológiai Klinika COPD-re gyanus betegek kérdőíves kiszűrése GOLD Szakértői Bizottság, 2002. nov COPD gyanúja azoknál a betegeknél merül fel, akik: • A napok többségében köhögnek • A napok többségében köpetet ürítenek • Fizikai aktivitásra a hasonló korosztályba tartozókhoz képest könnyebben kifulladnak • Életkoruk meghaladja a 40 évet • Aktív dohányosok vagy ex-dohányosok Legalább 3 kritérium fennállása esetén a COPD diagnózisának megerősítésére spirometriás vizsgálat szükséges. Diagnosztikus vizsgálatok COPD-ben INDIKÁCIÓ VIZSGÁLAT Alapvizsgálatok* • FEV1/FVC, FEV1 COPD gyanúja esetén • Reverzibilitási próba (inhalációs hörgőtágítóval ) • Mellkasröntgen Kiegészítő vizsgálatok • TGV *, RV, IC, IVC, TLC Középsúlyos/súlyos • TLCO/ KCO * COPD-ben •
Vérgázvizsgálatok • EKG * Járóbeteg szakellátásban, alapellátásban ajánlott * Testpletizmográffal mért térfogat * Az ATS ajánlásaiban „rutinvizsgálat”-ként szerepel Spirometria: a diagnózis arany standardja COPD-ben A FEV1, az FVC és a FEV1 / FVC arány meghatározása FEV (L) 5 FVC Normál FEV1 FVC 4 3 FEV1 COPD 2 1 FEV1 FVC FEV1/FVC Normál 4.15 5.2 80% COPD 2.35 3.9 60% 0 0 1 2 3 4 5 6 Idő (s) Ha a post-bronchodilatátor FEV1 / FVC arány ≤ 70% , diagnosztikus értékű COPD-re GOLD ajánlás (2006) Obstruktív ventilációs zavar: a FEV1 /IVC-hányados (Tiffeneau-index) csökkenése a referenciaértékhez viszonyítva > 1.64 RSD (az index korfüggő) COPD-ben a légúti obstrukció kritikus értéke fix: A post-bronnchodilatátor FEV1 /FVC Térfogat (L) hányados ≤ 70% 5 FVC FEV1 4 FVC 3 FVC FEV1 2 referencia-érték FEV1 1 post-bronchodilatátor pre-bronchodilatátor 0 0 1 2 3 4 5 6 Idő (s)
Post-bronchodilatátor FEV1 / FVC (1.6 L /29 L) = 550 % Post-bronchodilatátor FEV1 (ré.%) (16 L /42 L) = 380 % Δ FEV1 (0.15 L) = 103 % GOLD ajánlás (2006) Akut reverzibilitási próba A kilégzési áramláskorlátozottság reverzibilitásának vizsgálata hörgőtágítókkal,stabil állapotban A vizsgálat célja: • az asthmás és COPD-s betegek elkülönítése* • a post-bronchodilatátor FEV1 meghatározása Az ajánlott hörgőtágító dózisok: 400 µg rövid hatású 2-agonista vagy 80 µg antikolinerg hörgőtágító inhalációja (esetleg kombináltan) adagoló porlasztóból (toldalékkal). Mérések: inhaláció előtt, majd 30-45 perccel utána Értékelés: A kiindulási FEV1 értéket 12 %-kal meghaladó, de legalább 200 ml-es növekedése értékelhető reverzibilitásként Az asthmások ~ 30 %-a „fix”,nem reverzibilis funkciózavart mutat Kestens S,et al. Chest 1994105:1042-45 A nemzetközi diagnosztikus ajánlások által javasolt
reverzibilitási küszöb-értéket (β2-agonista belégzése után a FEV1 12 %-os és legalább 200 mL-es javulása) használva, az asthma azonosításának szenzitivitása 44%,a COPD-től való elkülőnítésének specificitása 72 %. Mannino DM,et al. Arch Intern Med 2000 160:1683-89 * Tüdőfunkciós tesztek alapján az asthma és a COPD között éles határvonal nem húzható. A COPD diagnózisának légzésfunkciós kritériumai (Spirometria: a diagnózis arany standardja!) Spirometriával kimutatható a COPD-re jellemző kilégzési áramláskorlátozottság – Fennállása diagnosztikusnak tekinthető ha a post-bronchodilatátor FEV1/ FVC arány 70 % – Nem teljes reverzibilitása hörgőtágítók után a FEV1 növekedése nem éri el a reverzibilitás küszöbszintjét, azaz a FEV1 < 12 % és < 200 mL – Súlyossági foka a post-bronchodilatátor FEV1 (r.é%) csökkenése alapján itélhető meg – Progresszív romlása hosszabb távon ( 3 év)
a post-bronchodilatátor FEV1 csökkenése > 50 mL/év (a fiziológiás csökkenés mértéke < 30 mL/év) A COPD spirometriás súlyossági fokozatai A COPD súlyossági fokozatai (I-IV.stádium) a postbronchodilatátor (PB) FEV1 (ré%) értékei alapján ítélhető meg: I.stádium Enyhe COPD PB FEV1(ré.%) ≥ 80 % II. stádium Közepesen súlyos COPD PB FEV1(ré.%) 50-79 % III. stádium Súlyos COPD PB FEV1(ré.%) 30-49 % IV. stádium Nagyon súlyos COPD PB FEV1(ré.%) < 30% COPD – progresszió: A légúti funkcióvesztés ütemének mérése prognosztikus értékű A veszélyeztetett csoport kiemelhető A post-bronchodilatátor FEV1-csökkenés megfigyelésével legaláb 3 éven át * („Gold standard”, a mortalitással egyenértékű végpont) * A fiziológiás 25-30 mL/év FEV1 csökkenés helyett az évi térfogatvesztés COPD-ben meghaladja az 50 mL-t Mellkasröntgen COPD-ben • Krónikus bronchitisre utaló jelek: -fokozott
bronchovascularis rajzolat, enyhe fibrosis -nagyobb szív, pulmonalis hypertoniában a jobb oldali arteria pulmonalis törzs átmérője > 16 mm • Emphysemára utaló jelek: -fokozott sugáráteresztés (parenchyma-tömeg/tüdővolumen arány csökkent) -csökkent perifériás vascularisatio, centro-periferiás érkaliber diszkrepancia -lapos, mélyen álló rekesz, tág bordaközök -kiszélesedett pre- és retrocardiális tér -kis, középen elhelyezkedő szív (gyakran cseppszív) (GOLD, 2003) Előrehaladott emphysema • Nagy térfogatú tüdők keskeny szívárnyékkal • A rekesz mindkét oldalon lapos • A transzparencia fokozott a felső lebenyekben, az érrajzolat gyengébb Hansel, Barnes. Atlas of COPD, 2004 Bullosus emphysema • A felső bulla érmentes területként látható a jobb felső lebenyben. A bulla alsó határán a fal egy vékony görbületként válik láthatóvá • A másik bulla a jobb alsó lebenyben látható Hansel, Barnes. Atlas of
COPD, 2004 α1-antitripszin hiány (panacinaris emphysema) • nagy térfogatú tüdők • lelapult,mélyen álló rekeszek • alsó tüdőterületek transzparenciája fokozott,az érrajzolat csökkent Cor pulmonale Krónikus légúti obstrukció, midkét oldalon kitágult pulmonalis artériákkal Cardiomegália (a tranzverz irányú szívátmérő> 50%-a a tranzverz tüdőátmérőnek Panacinaris emphysema Kórosnak tartott, a sugarakat csak kis mértékben elnyelő nagy területek láthatóak a felvételen (a panacinaris parenchyma destrukció következménye) Hansel, Barnes. Atlas of COPD, 2004 CT denzitometria COPD-ben A CT denzitometria kifejlesztése – mnt az emphysema in vivo mértéke – jobb lehetőséget nyújt a COPD individuális fenotípusainak jellemzésére, az emphysemás destrukciónak a FEV1-csökkenéshez való hozzájárulásának mértékéről. α1-AT hiányban sokkal szenzitívebb mértéke a betegség progressziójának,mint a
fiziológiai vagy egészségi állapotot jelző indexek és összefügg a „gold standard”-nak számító FEV1csökkenéssel. Szokványos COPD-ben a klinikai fenotípus általában sokkal heterogénebb mint α1-AThiányban és a CT denzitometria szerepe hosszú távú tanulmányokban még kevésbé bizonyított A COPD progresszióját hosszabb távon hagyományosan a FEV1-vasztés mértéke alapján becsülték fel,de ez az index nem specifikus mértéke az áramláskorlátozottságnak. A COPD heterogén szindróma,részkomponenseinek relatív hozzájárulása az áramláskorlátozottsághoz a FEV1 alapján nem identifikálható. Kiegészítő légzésfunkciós vizsgálatok középsúlyos/súlyos COPD-ben Statikus tüdőtérfogatok és kapacitások meghatározása COPD-re jellemző eltérések: – – TLC, TGV*, RV, IC, IC/TGV % ↓, IVC Az IC és TGV a hyperinfláció érzékeny markere A tüdő transzfer faktorának (diffúziós kapacitás) és
transzfer koefficiensének meghatározása CO-ra – TLCO/KCO : az emphysema súlyosságának markere Vérgázvizsgálat (ha a FEV1 * Testpletizmográffal mért térfogat < 40%, ha cyanosis merül fel) Diagnosztikus vizsgálatok COPD-ben INDIKÁCIÓK VIZSGÁLATOK Alapvizsgálatok CODP gyanúja esetén FEV1/FVC, FEV1, Kiegészítő vizsgálatok középsúlyos/súlyos COPD-ben Tüdőtérfogatok mérése Diffúziós zavar mérése Vérgázanalízis, EKG, Htk/Hb Purulens köpet Fiatalkori emphysema Asthma gyanúja Emphysema típusa/kiterjedése Obstruktív alvási apnoe Reverzibilitási próba Mellkasröntgen Köpettenyésztés, antibiogram Alfa1-antitripszin szérumszint PEF-monitorozás, terheléses vizsgálat,bronchialis reaktivitás HRCT Alvás alatti légzésvizsgálat A stabil COPD kezelése Vastag Endre Semmelweis Egyetem Pulmonológiai Klinika A kezelés célja COPD-ben • • • • • • • A rizikó tényezők csökkentése A progresszív
légúti funkcióvesztés megelőzése/fékezése A tünetek enyhítése A terhelési kapacitás és az életminőség javítása Az exacerbációk gyakoriságának/súlyosságának csökkentése A komplikációk megelőzése és kezelése A halálozás csökkentése /GOLD, Workshop Report 2001/ A COPD komplex kezelése • Prevenció - rizikofaktorok kiküszöbölése (dohányzás!) - immunizálás, immunmoduláció • Farmakoterápia - bronchodilatátorok, antibiotikumok, kortikoszteroidok, mucolitikumok • Oxigén-kezelés (rövid-,hosszú távú) • Gépi lélegeztetés (noninvasíve-NIPPV/invazív) • Műtét ( bullektomia, volumen-redukció, transzplantáció) • Rehabilitáció (légzőtorna,mellkasi fizióterápia,terheléses tréning,diétás tancsadás,psychoszociális támogatás ,betegoktatás) Biztosítja az elérhető optimális funkcionális állapotot • Folyamatos gondozás A COPD prevenciója • A dohányzás és más rizikófaktorok
kiküszöbőlése • • • • Az egyetlen beavatkozás, amely a progresszív légúti funkcióvesztést képes lefékezni (~ 30 %-kal csökkenti az exacerbációk incidenciáját) Évenkénti influenza elleni védőoltás (ősszel, vagy ősszel és télen) 50%-al csökkenti az influenza okozta akut exacerbációkat és a kapcsolatos mortalitást 5-6 évenként polivalens (23 virulens szerotipust tartalmazó) pneumococcus elleni védőoltás ( igazoltan a S. pneumoniae bakteriémiával társult fertőzésekben hatásos). Általános alkalmazásának szükségessége COPD-ben még megerősítésre szorul. Immunmoduláns kezelés, a légutakban leggyakrabban kimutatható 8 baktérium liofilizált kivonatával: Broncho-Vaxom kúraszerű alkalmazása csökkenti az exacerbációk gyakoriságát és a kórházi kezelések számát. Antioxidáns kezelés (N-acetylcystein) kúraszerű alkalmazása csökkenti az exacerbációk súlyosságát. A dohányzásról való leszokás
elősegítése A dohányzás kiiktatása a COPD minden súlyossági fokozatában az egyedüli hatásos - és költséghatékony – kezelés, amely hosszú távon bizonyítottan lassítja a tüdőfunkció progresszív romlását. A dohányzás abbahagyása esetén a nikotin utáni vágy és a megvonási tünetek csökkentésére • nikotinpótló készítmény (rágógumi,bőrtapasz,orrspray,sublingvális tabletta ) ajánlott : a kezelés tartama 6-12 hét a nikotinpótlás lépcsőzetes csökkentésével • antidepresszáns buproprion (Zyban) kezelés 7-12 héten át (2x150 mg/nap) • parciális nikotinreceptor agonista vareniklin (Champix) (12 hetes kezelés, sikeres leszokás esetén egy újabb 12 hetes kúra (2x1 mg/nap) mérlegelendő A stabil COPD farmakoterápiája (általános irányelvek) • A klinikai súlyossághoz illeszkedő lépcsőzetes kezelés • Folyamatos, azonos gyógyszerhatást biztosító terápia mindaddig,amíg a betegség súlyosbodása vagy
mellékhatások a „ fenntartó” kezelés megváltoztatását teszik szükségessé • A betegenként általában eltérő „ terápiás válasz ”- hoz igazított gyógyszerek és gyógyszeradagok alkalmazása A COPD I-IV súlyossági fokozataiban ajánlott fenntartó kezelés (GOLD,2006) I. ENYHE II. KÖZÉPSÚLYOS • FEV1/FVC< 70%* • FEV1/FVC< 70% • FEV1 > 80%* • 50%<FEV1<80%* Intermittáló panaszos Állandó panaszos III. SÚLYOS IV. NAGYON SÚLYOS • FEV1/FVC< 70%* • • FEV1/FVC < 70% • 30%<FEV1<50%* FEV1 < 30 %* vagy < 50 %* + krónikus légzési és/vagy Exacerbációk jobb szívfél-elégtelenség A kockázati tényezők (dohányzás!) kiküszöbölése, influenza vakcináció Rövid hatású hörgőtágítók (anticholinergikum és/vagy β2-agonista) szükség szerint Egy vagy több elhúzódó hatású inhalációs hörgőtágító Légzésrehabilitáció ( + előző lépcső) Inhalációs kortikoszteroid ( +
előző lépcsök ) * Post-bronchodilatátor értékek GOLD Workshop Report 2006 Tartós oxigén-kezelés (krón. légzési elégtelenség esetén) Sebészi kezelés ? ( + előző lépcsők) Hörgőtágítók stabil COPD-ben • A stabil COPD tüneti kezelésében és a komplikációk megelőzésében a bázisterápiát jelentik (A) • A β2-agonisták, az anticholinergikumok és a theophyllin vagy ezek kombinációi közötti választás a gyógyszerek elérhetőségének, a panaszok csökkenésével mérhető individuális hatásuknak és mellékhatásaiknak a függvénye • A tünetek megelőzésére és enyhítésére „szükség szerint” vagy „folytonosan” alkalmazhatók • Az inhalációs terápia előnyösebb, a terápiás hatás/kockázat arányt növeli • A hosszú hatású inhalációs bronchodilatátorok sokkal hatékonyabbak mint a rövid hatású szerek • A különböző támadáspontú és hatástartamú hörgőtágítók kombinált alkalmazása
növeli a terápiás haszon/kockázat arányt (GOLD 2003) Inhalációs β2-agonista és anticholinerg hörgőtágítók COPD-ben Rövid hatású hörgőtágítók − A stabil COPD minden súlyossági lépcsőjén (I-IV) adhatók szükség szerint vagy rendszeresen − Akut exacerbációban ! Hosszú hatású hörgőtágítók A COPD II-III-IV. súlyossági lépcsőjén egy vagy több szer kombináltan,folyamatosan adható Hörgőtágítók COPD-ben β2 agonisták Rövid hatású szerek Salbutamol (Ventolin Evohaler) Terbutalin (Bricanyl Turbuhaler) Fenoterol (Berotec N aerosol) Fenoterol/ipratropium bromid (Berodual N aeroszol) Hosszú hatású szerek Formoterol (Oxis Turbuhaler, Foradil inhalációs kapszula) Salmeterol (Serevent aeroszol, diszkusz) Anticholinerg szerek Rövid hatású szerek: Ipratropium bromid (Atrovent aeroszol) Hosszú hatású szer: Tiotropium bromid (Spiriva inh. kapszula + Handihaler) Hosszú hatású per os theophyllinek β2-agonista
hatások Bronchodilatáció β1 cardiális β2 pulmonális β3 zsirszövet β2-agonisták Plazma exudáció Cholinerg neurotranszmisszió Mucociliaris clearance Neutrofil funkció Baktérium adherencia β2- agonisták terápiás hatásai • Légúti simaizomzat közvetlen ellazítása (funkcionális agonisták) • Hyperinfláció csökkentése • Antiinflammációs hatás − Csökkentik a plazma exsudációt − Gátolják a neutrophilek toborzását,aktiválását − csökkentik a légúti nyálkahártyára tapadó bakrériumok számát • Mucociliaris clearance fokozása Rövid hatásü szerek: gyors hatáskezdet(percek),4-6 órás hatástartam Salbutamol, Terbutalin, Fenoterol Hosszú hatású (~12h) szerek: Formoterol (Oxis),Salmeterol (Serevent) Formoterol: gyors hatáskezdet ( percek),”sürgősségi” hörgőtágító is Hosszú hatású β2-agonista hatások • Prolongált bronchodilatáció (~ 12h),függetlenül a kiváltó oktol • Csökkentik a
dinamikus hyperinflációt • Enyhítik a dyspnoét • Javítják a terhelési toleranciát A tüneti javulás általában > FEV1-javulás • Csökketik az exacerbációk gyakoriságűt különösen súlyos COPD-ben • Javitják az életminőséget • Növelik a mucociliaris clearance-t ( csillók csapási frekvenciáját) Gyulladáscsökkentő hatásuk is van • Csökkentik a plazma exsudációt (a post-capilláris venulák endothelsejtjei közötti rések zárásával, amit gyulladásos mediátorok nyitnak meg) • Gátolják a neutrophilek toborzását és aktivációját (ezt a hatást a kortikoszteroidok fokozzák) Rövid és hosszú távú β2-receptor deszenzitizáció A β2-agonistával történt kapcsolódás hatására a receptor tulajdonságai megválzoznak • Tachyphylaxis a β2-receptor gyors deszenzitizációja A β2-agonistával történő első találkozás alkalmával (vagy fokozott β2-agonista használat esetén) alakul ki. Hátterében a β2-receptor
és a hatását közvetítő Gprotein közötti kapcsolat átmenetileg megszakad („uncoupling”), majd az agonista távozásával visszaáll az eredeti helyzet, azaz a receptor stimulálhatóvá válik. • Tolerancia a β2-receptor hosszú távú deszenzitizációja („downregulation”) Folyamatos β2-agonista hatás esetén a β2-receptorok száma csökken. A jelenség internalizáció néven ismert.Visszaszorul a β2- receptor gén-expresszió is,ami tartós „down-reguláció”-hoz és receptorvesztéshez vezet. (Négy héten át 4x200 mcg inhalációs salbutamol hatására a β2-receptor sűrűség a tüdőkben 22%-kal csökken és csökken a hörgőtágító hatás is.) Szintetikus inhalációs anticholinergikumok* Második generációs, rövid hatású (> 6 h), nem-szelektív (M1=M2=M3) szerek: – Ipratropium bromid – Oxitropium bromid Harmadik generációs, hosszú hatású (> 24 h), szelektív (M3, M1>M2) szer: – Tiotropium bromid (SPIRIVA) * Az
atropin kvaterner ammónium derivátumai, hidrofilitásuk miatt csak minimális mennyiségben (~ 1%) jutnak be a szisztémás keringésbe, így atropinszerű mellékhatásoktól csaknem mentesek. A stabil COPD fenntartó kezelésében elsőként választandó hörgőtágítók. A cholinerg idegaktivitást nikotin (N) és muszkarin (M) receptorok mediálják, a neurotranszmitter az ACh. preganglionalis ideg N (+) ACh kolinerg ganglion M1 (+) postganglionalis ideg M2 (-) ACh M3 (+) simaizom COPD-ben a bronchokonstrikció döntően ACh fokozott felszabadulásával kapcsolatos. Ennek mechanizmusa: – centrálisan mediált vagalis reflex-mechanizmus – az efferens kolinerg idegaktivitás fokozódása – M2 autoreceptorok károsodása Inhalációs anticholinergikumok terápiás hatásai • Csökkentik a fokozott cholinerg simaizomtónust: COPD-ben ez az obstrukció fő reverzibis komponense (hatáserősség 2-agonista) • Protektív hatásuk van
bronchokonstriktoros stimulusokkal szemben • A bronchialis szekrétumot enyhén csökkentik • A mucociliaris clearance-re hatástalanok • Atropinszerű szisztémás mellékhatásaik - eltekintve a szájszárazságtól nincsenek • Tolerancia tartós alkalmazás esetén sem alakul ki • Hatékony bronchodilatátorok nocturnalis, β-blokkolóval indukált,akut • És gyermekkori asthmában, idős betegeknél Tiotropium bromid: szelektív (M3, M1), hosszú hatású, inhalációs antikolinergikum Farmakológiai jellemzők • Receptor-affinitás (10x > ipratropium, M1 = M2 = M3) • Lassú disszociáció az M3 (34.6 óra*)- és M1 (14.6 h*)-receptorokról vs. M2 (36 óra*) • Kinetikus szelektivitás (M3 > M1 > M2) • Kolinerg bronchokonstrikció prolongált gátlása (> 24 óra) • Tartós bronchodilatáció ( 24 óra) • Naponta egyszer alkalmazandó (18 g) hörgőtágító * Receptor-tiotropium komplex felezési ideje A tiotropium bromid*
terápiás értéke • Szelektív M3 -receptor antagonizmus – – – – – – jobb tüdőfunkciós értékek kevesebb klinikai tünet ritkább exacerbáció és hospitalizáció jobb terhelési teljesítmény jobb életminőség nem alakul ki tolerancia • 24 órás hatás – napi egyszeri adagolás – jobb compliance * Első vonalbeli bronchodilatátor a COPD II-IV. súlyossági fokozataiban Theophyllinek • Hörgőtágító hatásuk mérsékelt • Alkalmazásuk COPD-ben korlátozott : alacsony hatás/rizikó arány (nem szelektív mellékhatások, farmakológiai interakciók ) • Anti-inflammációs hatásuk van – neutrophilek számát csökkentik (indukált sputumbam) – gátolják a netrophil kemotaxist Mechanizmus ? – IL-10 termelés növelése ?,adanozin-R antagonizmus ? – HDAC aktivitás növelése ? (gyulladásos gén expressió • A diaphragma kontrakcióját növelik ?) Hosszú hatású theophyllinek • A theophyllin kevésbé hatékony
hörgőtágító COPDben és potenciális toxicitása miatt előnyt élveznek az inhalációs hosszú hatású hörgőtágítók • Terápiás ablakuk szűk,kívánt szérumszintjük: 8-12 µg/mL • Monoterápiában való alkalmazásuk nem ajánlott • Az újabb kezelési irányelvek második, ill. harmadik vonalbeli gyógyszerként ajánlják COPD-ben • Inhalációs β2 agonistával és/vagy anticholinerg szerrel kombinálva additív hatás érhető el Inhalációs kortikoszteroid kezelés stabil COPD-ben Hatékonyságuk enyhe és mérsékelten súlyos stabil COPD-ben bizonytalan, csupán a betegek szűkebb, legfeljebb 10-15 %-át kitevő, asthmás jellemzőket mutató csoportjánál hatásosak. Krónikus kezelés szisztémás szteroidokkal a kedvezőtlen terápiás hatás/kockázat arány miatt kerülendő. Rendszeres inhalációs szteroid kezelés stabil COPD-ben csak tünetes betegeknél javasolt, ha - a post-bronchodilatátor FEV1 (r.é%) <50* 1 - az exacerbációk
gyakoriak (>3/év) (*légúti funkciójavulás hiányában is) *Ezekben az esetekben enyhén mérséklik a légúti funkcióvesztés ütemét, ritkítják az exacerbációkat, enyhítik a panaszokat és javítják az életminőséget Az inhalációs kortikoszteroidok hatása súlyos, stabil COPD-ben enyhén mérséklik a légúti funkcióvesztést csökkentik a panaszokat javítják a terhelhetőséget, életminőséget 25-30%-al csökkentik az exacerbációk számát/súlyosságát csökkentik a kórházi felvételek számát csökkentik a sürgösségi hörgőtágítók használatát hatásuk a mortalitásra ? Inhalációs kortikoszteroidok Beclomethason : Aldecin aeroszol Budesonid Fluticason : Pulmicort turbuhaler,aeroszol : Flixotide diszkusz, aeroszol Kombinációs készítmények Fluticason+salmeterol Seretid diszkusz Budesonid+formoterol Symbicort turbuhaler Hosszú távú (otthoni) oxigén-kezelés indikációi COPD-ben Az indikáció csak stabil
állapotban itélhetö meg, ha az adequat fenntartó gyógyszerelés mellett is konzisztens hypoxaemia áll fenn ( általában a COPD IV.stádiuma) • PaO2 <55 Hgmm (7,3 kPa) vagy a SaO2 < 88% hypercapnia (A) áll fenn,ill. a • PaO2 55-60 Hgmm (7,3-8,0 kPa) közötti vagy a SaO2 < 89 % + pulmonalis hypertonia, perifériás oedema, polycythemia (Htk > 55%) áll fenn (D) Naponta > 15 órás oxigén-kezelés 6-7 évvel nyujtja meg az életet Javítja a haemodinamikát, a pulmonalis hypertensio progresszióját,a hypoxaemia okozta Polycythaemiát,a tüdő mechanikát,a psyches állapotot,az életminőséget Oxigénpótlás. Beállítás:a PaO2 8 kPk ((60-65 Hgmm),a SaO2 90% fölé emelkedjen a PaCO2 < 2.0 kPa (15 Hgmm) emelkedése mellett - palackból orrszondán át,1-3 L/perc - oxigénkoncentrátorból 2-4 L/perc (olcsó,OKPTI engedély szükséges) - cseppfolyós oxigénellátó rendszerek (regionális szakfőorvos engedélyével) „COPD-ben a
farmakoterápia egyik formája sem képes a légúti funkció progresszív csökkenését megállítani” GOLD 2003 Igaz ez a legújabb vizsgálatok tükrében ? A pre-bronchodilatátor FEV1 érték változása egy éves tiotropium,illetve placebo kezelés mellett (Két 1 éves tiotropium–placebo kontrollos vizsgálat utólagos analízise) Mélyponti FEV1 (L) 8–344. nap 1.2 Tiotropium (n = 518) -12.4 mL/év * 1.1 Placebo (n = 328) 1 -58.0 mL/év 0.9 18 Napok 344 A tiotropium a tüdőfunkció progresszív romlását (azaz a kórlefolyást) hosszú távon kedvezően módosítja ? * p = 0.005 tiotropium versus placebo Anzueto és mtsai. Pulm Pharm & Therap 2005 AEffect terhelési tolerancia javulása tiotropium és pulmonális of Tiotropium on the Improvement in rehabilitáció kombinációja hatására COPD-ben Exercise Tolerance Resulting from Rehabilitation Study drug Tiotropium Állóképesség * (min) (min) Endurance time 24 * * Rehabilitáció
Rehabilitation 20 32% 42% 16 16% 12 8 0 2 4 6 * Futószőnyegen gyaloglás (0%-os lejtő) 3x/hét > 30 perc *P<0.05 8 10 12 14 16 18 20 22 24 Kezelés (hetek) Weeks on Treatment Tiotropium Placebo n=47 Casaburi n=44et al. Chest 2005;127:809–817 Casaburi et al. Chest 2005 127: 809 - 817 UPLIFT vizsgálat:Tiotropiummal végzett 4 éves vizsgálat COPD-ben Nemzetközi multicentrikus, randomizált, kettős vak, placebo kontrollált, paralell csoportos vizsgálat, középsúlyos-igen súlyos (az anticholinerg szerek kivételével korábban alkalmazott gyógyszereket használó) COPD-s betegen. Elsődleges végpontok: Pre-bronchodilatátor és post-bronchodilatátor (tiotropium+ rövid hatású anticholinerg+ β2-agonista adása után ) FEV1-érték éves csökkenése a 30. naptól („steady state”), a vizsgálat végéig Másodlagos végpontok: FVC-, IVC- csökkenés üteme,az első exacerbacióig és hospitalizációig eltelt idő, életminőség (SGRQ)
változása, össz-mortalitás Beteg populáció: 8020 betegből 5993 került randomizálásra.A legalább 45 hónapot komplettáló betegek száma 3569 (60%) volt Tashkin D, et al. NEJM 2008 359:1543-1554 UPLIFT : Pre- és post-bronchodilator FEV1 A tiotropium a placebohoz viszonyítva szignifikánsan (p<0.0001) javítja a tüdőfunkciót, (pre- és post-bronchodilatátor FEV1) még a maximális dózisokban alkalmazott salbutamol és ipratropium által elért javuláson túl is. 1,50 Tiotropium * * FEV FEV11(L) (L) 1,40 * * * * Control * 1,30 * * 1,20 * * * * * (n=2516) (n=2374) * * * 1,10 Post-bronch. FEV1 = 47 – 65 mL * (n=2494) (n=2363) 1,00 Pre-Bronch. FEV1 = 87 – 103 mL 0 01 30 nap (steady state) 6 12 18 24 30 36 42 48 Hónapok A tiotropiumot és placebot kapó csoportok között. a FEV1 éves csökkenési ütemében a különbség, sem a pre (30±1 mL)- sem a post-bronchodilatátor (30±1 mL) FEV1 vonatkozásában nem
szignifikáns Pre- és post-bronchodilator FVC Tiotropium 3,30 * * * FVC FVC(L) (L) 3,10 2,90 * * Control † * † † n=2516 Post-Bronch FVC = 32 - 65 mL n=2374 * * * * * * * * 2,70 * n=2494 Pre-Bronch FVC = 170 - 204 mL n=2363 2,50 0 0 1 30 nap (steady state) 6 12 18 24 30 Hónapok 36 42 48 *P<0.0001 vs kontroll †P<0.05 vs kontroll SGRQ Total Score Átlagértékek a mérési időpontokban SGRQ Total Score (Units) Javulás 50 Tiotropium (n = 2478) Control (n = 2337) SGRQ Total Score 45 40 * * 6 12 * * * * 30 36 * * 35 0 0 18 24 Hónapok *P<0.0001 vs kontroll 42 48 = 2.3 – 33 units Probability ofvalószínűsége exacerbation (%) Exacerbatiók (%) COPD exacerbatiók valószínűsége Tiotropium 80 Control 14% rizikó-csökkenés 60 40 Hazard ratio = 0.86, (95% CI, 0.81, 091) 20 p < 0.001 (log-rank test) 0 0 6 12 18 24 30 Hónapok Month 36 42 48
Hospitalizációt igénylő COPD exacerbációk valószínűsége Probability of exacerbation leading Hospitalizációt igénylő COPD to hospitalization (%) exacerbációk valószínűsége (%) Tiotropium Kontroll 40 30 14% rizikó-csökkenés 20 Hazard ratio = 0.86, (95% CI, 0.78, 095) 10 p=0.002 (log-rank test) 0 0 6 12 18 24 30 Hónapok 36 42 48 ICS és LABA kombinációja • A LABA és az ICS együttes alkalmazása a COPD pathofiziológiájának különböző aspektusait befolyásolja (légúti obstrukció, mucociliáris dysfunkció, légúti gyulladás, strukturális változások) • együttes alkalmazás kapcsán pozitív hatások (szinergizmus?): - kifejezettebb hatás érvényesül - segít kivédeni az egyes komponensek negatív hatásait ( ICS csökkenti a ß2- receptorok down regulációját és fokozza a receptor szintézis intenzitását- csökkenti a toleranciakialakulását. LABA ellensúlyozhatja az ICS gyenge légzésfunkciós romlást
befolyásoló hatását) LABA+ICS kombiált kezelés (3 hónap) csökkenti a légúti gyulladás intenzitását középsúlyos/súlyos stabil COPD-ben − Randomizált, kettős-vak, placebóval kontrollált vizsgálat − 67 dohányos vagy ex-dohányos (> 10 pys) stabil COPD-s beteg (GOLD II-III. súlyossági fokozat) − 13 hetes salmeterol+fluticason (2x50/500 µg) kezelés vs. placebo Kezelt csoport versus placebo: − A hörgőbiopsziás mintákban szignifikánsan csökkent a CD45+ -,CD8+ ,CD4+ -,TNF-α-mRNA+ - és a hízósejtek száma − Az indukált köpetben szignifikánsan csökkent (p<0.037) a neutrofil sejtek száma − A CD8+, a TNF-α-mRNA+ és az IFN-ﻻ-mRNA+ sejtek csökkenése között szignifikáns (p<0.001) pozitív összefüggés állt fenn − A gyulladáscsökkentő hatást a légúti funkció jelentős (p<0.001) javulása kísérte Barnes N,et al. AJRCCM 2006 A hosszú hatású β2-agonisták és a kortikoszteroidok kölcsönhatása
β2-agonista hörgőtágító hatás membrán Kortikoszteroidok gyulladáscsökkentő hatás β2 receptor + + kortikoszteroid receptor Fokozzák a kortikoszteroid receptor Fokozzák a β2-receptor gén transzkripcióját, és ily módon a receptor ”up-regulációját”, a transzlokációját a citoplazmából szintézis intenzitását és megfordítják a a hatás helyére, a nukleusba receptor „down-regulációját” TORCH Calverley P,et al. NEJM 2007 356:775-789 Rabe KF. NEJM 2007 356: 851-852 Randomizált betegszám: 6112. A vizsgálatból a placebó ágban (P) 851, a salmeterol ágban (S) 960, a fluticason ágban (F) 947, a salmeterol/fluticason ágban (SFC) 1011 beteg maradt ki. Vizsgálat kérdése: A salmeterol/fluticason kombináció (SFC),a nagy adag inhalációs kortikoszteroid fluticason (F) és az elhúzódó hatású β2 agonista salmeterol (S) külön-külön befolyásolja-e – a placebo ággal összehasonlítva - a mortalitást 3 éven át tartó
kezelés alatt közepesen súlyos és súlyos COPD-ben (med. post-bronchodilatátor FEV1: 44 %, 10 % alatti reverzibilitással) Másodlagos végpontok (post-bronchodilatátor FEV1,tünetek,életminőség,exacerbatiók száma) TORCH : Össz-mortalitás (3 éven át tartó kezelés és megfigyelés alatt, közepesen súlyos és súlyos ( med.FEV1 : 44% ) COPD-ben) Az ICS/LABA kombináció össz-halálozást csökkentő hatása nem bizonyult szignifikánsnak (a statisztikai szignifikancia szintjén maradt) AZ ICS ( fluticason ) önmagában nem ajánlható COPD-ben. A S, ill. az SFC kombináció mortalitást befolyásoló hatása között nincs szignifikáns eltérés 16 (%) 16.0 % 15.2 % Placebo (n=851) Salmeterol (S) 2x50µg (n=960) Fluticason (F) 2x500 µg (n=947) SFC 2x50/500 µg (n=1011) 12 13.5 % 12.6 % 8 4 HR, 0.825 (95% Cl, 0.681-1002) P ( Placebo vs. SCF) = 0052 (long-rank test) 0 0 24 48 72 Hetek 96 120 156 Calverley P,et al. NEJM 2007 356:775-789 Rabe KF.
NEJM 2007 356:851-852 8 TORCH : COPD-vel ősszefüggő halálozás valószínűsége (%) Placebo Salmeterol (S) : 2X50 µg Fluticason (F) : 2X500 µg SF : 2X50/500µg 6 6.9% 6.1% 6.0% 4.7% 4 2 0 0 24 48 72 Hetek 96 120 156 Carverley P,et al. NEJM 2007 356:775-789 Rabe KF. NEJM 2007 356: 51-852 TORCH : Farmakoterápia hatása a tüdőfunkció csökkenésének sebességére középsúlyos, súlyos COPD-ben 1350 Post-bronchodilatátor FEV1 (mL) Placebo Salmeterol (S) : 2X50 µg Fluticason (F) : 2X500 µg SFC : 2X50/500µg 1300 1250 - 39 mL/év P < 0.001 1200 - 42 mL/év - 42 mL/év P < 0.003 1150 Az SCF kombinált-,valamint az S és F kezelés önmagában, szignifikánsan lassítja a légúti funkció romlását placebóhoz képest. Farmakoterápiával a COPD kórfejlődése lassítható. 1100 - 55 mL/év 0 0 24 48 72 Hetek 96 120 156 Celli BR,et al. AJRCCM 2008 178:332-338 TORCH: Összefüggés az egyes terápiás (P,S,F,SFC) hatások
és az évi FEV1 csökkenés között A FEV1-csökkenés a COPD kórfejlődésének megbízható markere. A TORCH vizsgálatban a placebo ágban mért med. FEV1-csökkenés (55mL/év) hasonló volt, mint a Lung Health Study-ban (47 mL/év), a BRONCUS (54mL/év) és ISOLDE (59mL/év) vizsgálatokban. A placebóval kezelt csoporthoz képest a med. évi, postbronchodilatátor FEV1csökkenés a salmeterollal és fluticasonnal kezelt csoportokban átlagosan 13 mL-rel (p < 0.003), a salmeterol / fluticason kombinációval kezelt csoportban 16 mL-re (p < 0.001), szignifikánsan alacsonyabb volt Az aktív kezelés jelentősen mérsékelte a meredek légúti funkció-romlást. Ennek hátterében a hyperinfláció,a légúti gyulladás csökkenése és a mucociliaris clearance javulása egyaránt állhat. A vizsgálat bizonyítékot szolgáltatott arra,hogy farmakoterápiával a COPD kórfejlődése sikerrel befolyásolható. Hatásos, kombinált, fenntartó kezelés (a COPD akut
exacerbációinak megelőzése) - LABA+LAMA kombináció - LABA+ ICS kombináció - LABA és LAMA + ICS kombináció - LABA és LAMA + ICS (+ teofillin?/+PD-4 gátlók?) LABA: elhúzódó hatású ß2-agonista aeroszol LAMA: elhúzódó hatású atikolinerg aeroszol ICS: inhalációs kortikoszteroid. PD4-gátlók: foszfodiészteráz4-gátlók A COPD akut execerbációjának kezelése A COPD klinikai lefolyása COPD Kilégzési áramláskorlátozottság Exacerbációk AIR TRAPPING Hiperinfláció Légszomj Dekondicionálodás − Optimalizálja a kilégzési áramlás generálását − Súlyos restriktív mechanikai deficitet eredményez Inaktivitás Csökkent terhelhetőség Csökkent életminőség Rokkantság Betegség progressziója Halál A COPD akut exacerbációi • A lokális és szisztémás gyulladás, valamint a klinikai tünetek akut fokozódásával járó elhúzódó epizódok • Gyakoriságuk a COPD fenotípusától („bronchitiszes” B-típusú
COPD-ben szenvedők fogékonyabbak infekciókkal szemben) és súlyosságától függ • A kezelés módosítását, gyakran kórházi ellátást tesznek szükségessé • Gyakoriságukkal és súlyosságukkal nő a rövd távú mortalitás ( 0.75 L alatti FEV1 esetén az 1 és 10 éven belüli halálozás 30-ill. 90%) és romlik a túlélők funkcionális állapota és életminősége A 2006-os GOLD-ajánlás tünet/esemény alapú definiciója „ a COPD exacerbációját a betegség természetes lefolyását megszakító eseményként definiálja, amelyet a beteg bazális tüneteiben (nehézlégzés,köhögés és/vagy köpetürítés) bekövetkező olyan mértékű változás (romlás) jellemez, amely meghaladja az egyébként előforduló naponkénti változások mértékét, akutan lép fel és változtatást igényel a beteg szokványos kezelésében ” A tüdőfunkció ingadozása COPD-ben Légúti funkció Légúti funkció a stabil klinikai állapot
„normális” ingadozása „exacerbáció” szintjét elérő állapotromlás Idő Idő COPD exacerbáció Anthonisen: tünet-alapú definíció és súlyossági besorolás Major tünetek (Winnipeg kritériumok) Tünet-alapú súlyosság: • fokozódó dyspnoe • fokozódó köpetmennyiség • purulencia megjelenése,fokozódása 1.típus: 3 major tünet * 2.típus: 2 major tünet 3.típus: 1 major + 2 minor tünet ± Minor tünetek: torokfájdalom a megelőző 5 napban, orrfolyás, fokozodó zihálás, mellkasi feszülés, más okkal nem magyarázható láz, új röntgen-eltérés, szív/légzési frekvencia > 20%-os növekedése, leukocitózis *antibiotikus kezelés ajánlott, szignifikáns előnyökkel jár Anthonisen NR, Ann Intern Med 1987 Minél súlyosabb a COPD, annál gyakoribbak az exacerbációk. Burge PS és mtsai: the ISOLDE TRAYEL BMJ 2000: 320: 1297-1303 * COPD (II-IV) = az akut exacerbációk átlagos gyakorisága 3/év (1- 8 exacerbáció)
és ezek felében nem fordulnak orvosi segitségért. Seemungal TAR,et al. AJRCCM 1998 157: 1418-1422 A COPD exacerbációk hatásai • • • • • • Fokozzák a tüneteket Csökkentik a tüdőfunkciót Rontják az életminőséget Növelik a mortalitást Gyakoribb exacerbációk – gyorsabb FEV1 csökkenés A felépülés után a betegség progressziója felgyorsul Seemungal et al. AJRCCM 1998/2000 Donaldson et al. Thorax 2002 Fan et al. Chest 2002 A COPD akut exacerbációja Mortalitás Kórházi kezelést igénylő súlyos esetekben: 3-10% Intenzív légzésterápiát igénylő esetekben (65 évesnél idősebbek esetében): >30% A COPD exacrbációja miatta halálozás rizikoját a respiratorikus acidózis, bizonyos társbetegségek megléte, és a lélegeztetés szükségessége határozza meg. Az akut exacerbáció súlyosságának megítélése Az exacerbációt megelőző kórtörténet áttekintése • A stabil állapot súlyosságnak
megítélése,FEV1- érték • A korábbi exacerbációk gyakorisága,súlyossága/hospitalizációk szükségessége • Az újonnan megjelent tünetek intenzitása,tartama • Korábbi fenntartó kezelés A súlyosság jegyei • Légzési segédizmok használata • Paradox mellkasfal-mozgás • Centrális cyanosis kialakulása/mélyülése • Perifériás oedéma kialakulása • Haemodinamikai instabilitás • Jobb szívfél-elégtelenség jelei ( juguláris vénás nyomás, tapintható máj, oedema) • Csökkent éberségi szint, zavart tudat COPD akut exacerbáció: kórházi felvétel indikációi • A tünetek intenzitásának markáns változása (pl.hirtelen fokozódó nyugalmi nehézlégzés) • Súlyos stabil COPD (mint alap) • A beteg állapota a megkezdett rohamoldó kezelésre nem javul • Újonnan megjelenő fizikális jelek (cyanosis,perifériás oedema) • Szignifikáns társbetegségek • Gyakori exacerbációk • Újonnan kialakult arrythmiák •
Diagnosztikus bizonytalanság • Idős (65 év feletti) kor A COPD akut exacerbációjának kezelése A fenntartó kezelés módosítása • Rövid hatású,inhalációs hörgőtágító kezelés (dózis/alkalmazási gyakoriság emelése) • Rövid tartamú (10-14 nap) orális/parenterális kortikoszteroid kezelés • Antibiotikus kezelés : fokozódó dyspnoe,fokozódó mennyiségű,purulens köpet esetén (B evidencia) Indikációk fennállása • Rövid távú,kontrollált oxigén kezelés esetén • Nem invazív pozitív nyomású gépi lélegeztetés (NIPPV) * * Antibiotikus kezelés • Invazív gépi lélegeztetés * (B evidencia) • Folyadékháztartás monitorozása,táplálás • Antikoaguláns kezelés mérlegelése (embolisatio esetén) • Komplikációk,szövődmények kezelése: a súlyos tünetek hátterében pneumonia, tüdőembólia, ptx, balkamra-elégtelenség, felborult cukoranyagcsere, progrediáló carcinoma állhat GOLD 2006 A COPD akut
exacerbációjának kezelése • Rövid hatású inhalációs hörgőtágitó kezelés (adagoló aeroszol + toldalék, levegő-hajtású kompresszoros porlasztó) A fenntartó hörgőtágító kezelés módosítása szükséges (adag/adagolás gyakoriság növelése)) – β2-agonista* aeroszolból maximum 300-400 µg 1-2 óránként – anticholinerg aeroszol (ipratropium) 60-80 µg 3-4 óránként • 10-14 napon át orális/parenterális kortikoszteroid kezelés ( metilprednizolon 40 mg /nap). *Az ajánlott hörgőtágító akut exacerbációban.Ha β2 agonistával gyors légúti hatás nem jelentkezik, akkor anticholinerg aeroszollal kiegészítés Az akut exacerbációk kezelése porlasztott hörgőtágítókkal • Ventolin (salbutamol) oldat (0.5%) 0.5mL* (2.5-50 mg) naponta 4X • Berotec (fenoterol) oldat (0.1%) 0.5-10 mL* (2.5-50 mg) naponta 4X • Atrovent (ipratropium bromid) oldat (0.025%) 1-2 mL* (0.25-05 mg) naponta 4X • Berodual oldat (ipratropium 0.025%
+ fenoterol 005%) 1-2 mL* (0.25-05 mg ipratropium + 05-10 mg fenoterol) naponta 4X A hörgőtágító aeroszol kezelést kompresszoros porlasztóval célszerű végezni, általában 4-6 óránként. 100%-os oxigénnel hajtott porlasztok alkalmazása respirációs acidózisban ellenjavallt * 2-4mL fiziológiás sóoldatban hígítva A COPD akut exacerbációinak antibiotikus kezelése Az enyhe esetek spontán gyógyhajlama jó Antibiotikus kezelés az akut exacerbációk súlyos eseteiben indokolt • ha az infekció mindhárom major tünete (fozódó mennyiségű köpet-ürítés,a köpet purulencia fokozódása, fokozódó dyspnoe) fennáll (B evidencia) • ha a beteg idős, kis légzési tartalékkal rendelkezik, társbetegségekben szenved (pangásos szívelégtelenség hipertonia,stb.),akinél évente legalább 3-4 exacerbáció jelentkezik és gyakran kényszerül orális szteroid kezelésre (10-30 %-uk intenzív légzéstámogatásra szorul) Cél: Az infekció gyors
leküzdése (baktérium eradikáció,baktérium koncentráció csökkentése), a szövődmények megelőzése Rövid távú kontrollált oxigén-kezelés (A sürgősségi ellátás első lépése) Indikációk: • PaO2< 55 Hgmm (7,3 kPa) vagy a SaO2< 88% hypercapnia (A) • PaO2 55-60 Hgmm (7,3-8,0 kPa) vagy SaO2 89 % + pulmonalis hypertonia, perifériás oedema, polycythemia (Htk > 55%) (D) Rövid távú oxigén-kezelés algoritmusa akut exacerbációban* PaO2 < 60 Hgmm (8.0 kPa) (szobalevegőn) O2-kezelés kezdeti FIO2 24% Kontroll 30-60 min között Javulás PaO2 > 60 Hgmm Javulás nem megfelelő FI,O 2 lépcsőzetesen Kontroll 30 min-ként Kontroll 4 óránként FIO2 24% PaO 2 > 60 Hgmm,stabilan Kontroll 4 óránként PaCO2 : < 10 Hgmm PaO2 > 60 Hgmm stabilan Éberség csökkenése PaO2 < 40 Hgmm (5.3kPa) PaCO2 >60 Hgmm (8.0kPa) vagy pH < 7.25 FI,O 2 > 40%+ NIPPV mellett FIO2 lépcsőzetes Kontroll 4 óránként LTOT
mérlegelése ITO A COPD akut exacerbációinak leggyakoribb kórokozói Csoport/ definició A. Enyhe exacerbáció: a kimenetelt rontó tényező * nélkül Leggyakoribb kórokozók • H.influenzae • S.pneumoniae • M.catarrhalis • C.pneumoniae • Virusok B. Mérsékelten súlyos exacerbáció A csoport + a kimenetelt rontó tényezővel • Penicillin rezisztens S.pneumoniae • Enterobacteriaceae (K.pneumoniae, E.coli,Proteus,etc) C. Súlyos exacerbáció P.aeruginosa veszélye mellett B csoport + • P.aeruginosa * Kisérő betegségek, súlyos COPD, >3 exacerbáció/év,antibiotikus kezelés 3 hónapon belül A COPD akut exacerbációja súlyossági fokozatai szerint ajánlott antibiotikus kezelés(GOLD,2006) Súlyossági csoport A. Enyhe exacerbació B. Mérsékelten súlyos exacerbáció C. Súlyos exacerbáció Oralis kezelés Egy cardinalis tünet* esetén antibiotikum nem szükséges, ha mégis,akkor β laktám,tetracyclin trimetoprim/sulfametyasol
β laktám/β laktamáz inhibitor Alternatív oralis kezelés Parenteralis kezelés β lactam/β lactamáz inhibitor Makrolidok Cephalospor. (ii-iii) Ketolidek ( telitromycin) Respirációs fluorokinolonok β laktám/β laktamáz inhibitor (Co-amoxclav) Ampicillin/Sulbactam Cephalospor.(II III) Fluorokinolonok (Levo-Moxifloxacin) Fluorokinolonok (Cipro-levofloxacin) β laktám P.aeruginosa aktivitással A non-invazív pozitív nyomású gépi lélegeztetés (NIPPV) indikációja a COPD akut exacerbációjában Az alábbi kritériumok közül legalább kettő fennállása • Középsúlyos/súlyos dyspnoe, a légzési segédizmok használata,paradox abdominális mozgás • Középsúlyos/súlyos acidózis (pH: 7.3-735) és hypercapnia (PaCO2 > 45 Hgmm, 6.0 kPa) • Légzési frekvencia > 25/min A non-invazív pozitív nyomású gépi lélegeztetés (NIPPV) a COPD akut exacerbációjában • • • • • a pH emelkedik a dyspnoe csökken a PaCO2 csőkken a
kórházi mortalitás csökken az intubáció és kontrollált gépi lélegeztetés gyakorisága csökken (az esetek 80-85%-ában az intervenció sikeres) Az invazív gépi lélegeztetés indikációi a COPD akut exacerbációjában • NIPPV hatástalanság esetén: a beteg nem tolerálja vagy nem alkalmas a noninvazív intermittáló légzéstámogatásra • Súlyos dyspnoe,légzési segédizmok használata,paradox hasi mozgás • Légzési frekvencia > 35/min • PaO2 < 40 Hgmm, PaCO2 > 60 Hgmm (8.0 kPa), pH < 725 • Aluszékonyság,tudatzavar • Cardiovascolaris komplikációk (hypotensio,shock,szívelégtelenség) • Sepsis,pneumonia,pulmonalis embolisatio,stb. • Légzésleállás • Egyéb komplikációk (pneumonia, tüdőembolisatio.sepsis, stb) Köszönöm a figyelmet ! Kortikoszteroid rezisztencia COPD-ben Teofillin (< 10 mg · L-1) Antioxidánsok? NO szintetáz inhibitorok? Cigarettafüst Oxidatív stressz Peroxinitritek Ө HDAC
inhibitor trichostatin Kortikoszteroidok? Hiszton deacetiláz (HDAC) aktivitás csökken * Hiszton acetiltranszferáz aktivitás - Gyulladásos gének (IL-8,TNF-α,etc.) expressziója nő * Bazális aktivitása COPD-s dohányosokban < mint „normál” dohányosokban COPD: akut exacerbáció (Az exacerbáció és súlyosságának standardizált definiálása hiányzik) Tüneteken alapuló definició: • Anthonisen N (1987) • Rodriguez-Roisin N (2000) Az egészségügyi ellátás (terápia/beavatkozás) igénybevételének szükségességén alapúló definició: • Enyhe exacerbáció: a szokásos terápia módosítását (adag/adagolás gyakoriság növelését) teszi szükségessé • Középsúlyos exacerbáció: Antibiotikum és/vagy orális alkalmazását teszi szükségessé • Kórházi ellátást igényel kortikoszteroid A COPD exacerbációja Konszenzus definíció: „a beteg állapotának elhúzódó rosszabbodása, amely a stabil
klinikai állapot „normál” naponkénti ingadozásának mértékét meghaladja, akutan lép fel és az alapbetegség fenntartó kezelésének megváltoztatását teszi szükségessé” Fokozatai (az egészségügyi ellátás igénybevétélének szükségessége alapján): Enyhe exacerbáció: a szokásos terápia változtatását,az akalmazott szerek dózisának emelését igényli Középsúlyos exacerbáció: antibiotikum és/vagy szteroid bevezetése szükséges Súlyos exacerbáció: kórházi ellátás szükséges Rodriguez-Roisin R. Chest, 2000 A COPD exacerbációinak következményei Emelkedett mortalitás az exacerbációk hospitalizációjával Csökkent egészségfüggő életminőség Exacerbációk FEV1 gyorsult csökkenése Az egészségügyi források fokozott igénybevétele, magasabb közvetlen költségek Az exacerbációk gyakoriságának hatása a légúti funkcióvsztés Exacerbations and FEV in the 1 decline (FEV1- csökkenés) ütemére az „
East London Study”-ban East London Study 0.95 Nem gyakori exacerbációk (< 3/év): Infrequent med.FEVexacerbators 1- csökkenés 32 mL/év FEV1 (L) Az 0.90 exacerbációk gyakoriságának hatása a FEV1 csökkenésére COPD-ben 0.85 0.80 (East London Gyakori exacerbációk (>Study) 3/év): Frequent med.FEV exacerbators 1 csökkenés 40 mL/év 0.75 0 1 2 3 4 Évek Years Donaldson et al. Thorax 2002;57:847–852 Elhúzódó gyógyulás exacerbáció(k) után COPD-ben : HRQL SGRQ total score Exacerbation(s) follow up Egy második during exacerbáció a (n=133) 6 hónapos 60 No further exacerbations (n=299) Exaccerbáció-mentesség a követés követés alatt (n=133) alatt (n=299) • Kezdeti gyors javulás 55 Romlás • Lassúbb hosszú-távú gyógyulás elhúzódó hatással az egészségre 50 45 • Egy második exacerbáció 6 hónapon belül szignifikánsan (p<0.006) lassítja a gyógyulást 40 35 30 Presentation Prezentáció 4 weeks 4
hét 12 12weeks hét 2626 weeks hét Spencer S, et al. Thorax 2003;58:589–593 Az akut exacerbációk megelőzése A ß2-receptor agonisták kombinált alkalmazása COPD-ben (GOLD 2003) • A hosszú hatású ß2- agonisták inhalativ szteroiddal való kombinációja, hatásosabb, mint az egyes szerek önmagukban. (A bizonyíték) ICS+LABA kombinációs kezelés gyulladáscsökkentő hatása stabil (GOLD II-III. fokozat) COPD-ben Javulás Placebo Javulás SALM/FP Bronchialis biopsziás anyag ΔFEV1 (L) SALM/FP 50/500 vs.Placebo Hetek . Barnes N, et al 2006 AJRCCM VA exacerbációs vizsgálat Exacerbációk/betegév exacerbációs napok / Exacerbációs napok/ betegév betegév 1.2 18 1 16 14 0.8 12 0.6 10 8 0.4 6 4 0.2 2 00 19% csökkenés 18 21% csökkenés 14 12 p<0.05 1.05 1.05 0.85 6 0.85 p<0.05 16.0 16.0 12.6 12.6 Placebo Tiotropium 2 0 Placebo Placebo Tiotropium Tiotropium Niewoehner és mtsai. Ann Intern Med (2005)
MISTRAL: az exacerbációk száma 3 Tiotropium (n=497) 34% csökkenés* Placebo (n=506) Exacerbáció/év 2.5 35% csökkenés* 2 1.5 1 0.5 0 Összes exacerbáció *p<0.01 Mérsékelt vagy súlyos exacerbáció A kombinációs kezelés (LABA+ICS) megnyújtja az első exacerbációig eltelt időt Symbicort 254 Budesonide 178 Formoterol 154 Placebo 96 0 100 200 300 Az első exacerbációig eltelt napok számtani közepe Calverley PM, et al. Eur Respir J 2003;22:912–919 Symbicort csökkenti az orvosi beavatkozást igénylő exacerbációk számát Átlagos exacerbáció szám/ beteg/év Szafranski 2.0 Calverley 1.9 1.9 2.0 1.8 1.8 1.6 1.4 1.8 1.8 * 1.6 1.6 1.4 1.4 1.4 1.2 1.2 1.0 1.0 0.8 0.8 0.6 0.6 0.4 0.4 0.2 0.2 0 0 Symbicort Budesonid * 1.6 Formoterol Placebo *p<0.05 vs placebo; p=0.043 Symbicort vs formoterol Szafranski W, et al. Eur Respir J 2003;21:74–81 Calverley PM, et al. Eur Respir J 2003; 22: 912-919
Symbicort Budesonid Formoterol *p<0.05 vs placebo; p=0.015 Symbicort vs formoterol Placebo A kombinációs kezelés javítja az életminőséget (SGRQ total score) Átlagos SGRQ total score Szafranski csökkenés vs placebo Symbicort Budesonide Formoterol Calverley Symbicort 0 0 -1 -1 -2 -2 -1.9 -3 -3 -4 -4 -5 -3.9 -3.5 * * -6 -7 -8 Budesonide Formoterol -3.0 * -4.1 * -5 -6 *p<0.01 vs placebo *p<0.05 vs placebo A beteg szempontjából releváns, klinikailag is mérvadó változás Szafranski W, et al. Eur Respir J 2003;21:74–81 Calverley PM, et al. Eur Respir J 2003; 22: 912-919 -7 -8 *p<0.001 vs placebo -7.5 *p<0.01 vs placebo * *p<0.05 vs placebo; p=0.014 Symbicort vs formoterol; p=0.001 Symbicort vs budesonide A kombinációs kezelés csökkenti a rohamoldó 2-agonista használat mértékét Átl. különbség rohamoldó használat számban/ 24 h a komb. kezelés előtti időszakhoz képest vs. placebo Symbicort
Szafranski Calverley Symbicort Budesonide Formoterol 0 Budesonide Formoterol 0 0.0 -0.5 -0.4 -0.5 * -0.6 * -0.8 -1 -1 * -1.2 -1.3 -1.5 * * *p0.001 vs placebo; p<0.001 Symbicort vs budesonide Szafranski W, et al. Eur Respir J 2003;21:74–81 Calverley PM, et al. Eur Respir J 2003; 22: 912-919 -1.5 *p<0.001 vs placebo; *p<0.01 vs placebo; p<0.001 Symbicort vs budesonide; p=0.032 Symbicort vs formoterol Symbicort csökkenti az orvosi beavatkozást igénylő exacerbációk arányát Exacerbációk aránya vs placebo (%) Symbicort Szafranski Budesonid Calverley Formoterol 0 Symbicort Budesonid 5 Formoterol +3% 0 -2% -5 -5 -10 -10 -15 -15 -12% -15% -20 -20 -25 * -30 -25 -24% *p<0.05 vs placebo; p=0.043 Symbicort vs formoterol Szafranski W, et al. Eur Respir J 2003;21:74–81 Calverley PM, et al. Eur Respir J 2003; 22: 912-919 -24% * -30 *p<0.05 vs placebo; p=0.015 Symbicort vs formoterol A betegség
progressziójának hipotetikus modellje COPD-ben A betegség progressziója 100 75 Exac 50 Rokkantság 25 Halál 0 0 25 50 Életkor (évek) 75 Napi med.PEF (bazális %) A PEF változása exacerbáció alatt 101 100 99 98 97 96 95 -14 -7 0 7 14 21 28 Napok Seemungal et al, AJRCCM 2000 Az exacerbáció hatása a COPD progressziójának ütemére A betegség progressziója 100 75 Exac 50 Rokkantság 25 Halál 0 0 25 50 Életkor (évek) 75 A COPD exacerbációinak infekciós eredete A krónikus bronchitis exacerbációinak 80%-a infekciós eredetű*: 40-50%-ban baktériumok (Haemophylus influenzae, Moraxella catarrhalis, Streptococcus pneumoniae) 30%-ban vírusok (influenza, RSV) 5-10%-ban atípusos baktériumok (Chlamydia pneumoniae, Mycoplasma pneumoniae) Az esetek 5-10%-ában egynél több patogén okozza az exacerbációt (B evidencia) * A súlyos exacerbációk ~ 1/3-ában a kiváltó ok nem identifikákható Sethi S. : Chest 2000: 117: 380S-385S
Β2-receptor deszenzitizáció a β2-agonista β2-receptor Ciklikus AMP IL-1β AMP Kortikoszteroidok β2-R / agonista tartós kötődés GRK-2 (G-protein receptor kináz-2) aktiváció 2-R/Gs-protein szétkapcsolás AC aktiváció és 2-agonista hatás elmarad. A deszenzitizációt gyulladásos stimulusok (pl IL-1) fokozzák, míg a kortikoszteroidok visszafordítják. 2-agonista / kortikoszteroid interakció β2-agonista expozíció cAMP-szint nő PKA aktiválódik a szteroid receptorok közvetlenül vagy közvetve (MAPK aktiváció) áthelyeződnek a nucleusba Az exacerbációk differenciáldiagnózisa • Pneumonia • Tüdőembolia • Congestív szívelégtelenség • Pneumothorax • Pleuralis folyadékgyülem • Arrythmiák • Nem kontrllált tünetekkel járó stabil COPD Egy éves tiotropium kezelés hatása a tüdőfunkcióra COPD-ben (vs. Placebo) 1. nap 8. nap 92. nap FEV1 (L) 1.3 344. nap Tiotropium (n=518) 1.2 1.1
1.0 Placebo (n=328) 0.9 -60 -5 30 60 120 180 Idő (perc) Casaburi R et al. Eur Respir J (2002) Különbség a 28. napon ( T – P, mL) A spirometriás paraméterek javulása 28 napos tiotropium kezelés hatására placebóhoz képest Tiotropium előtt (pre-bronchodilatátor) 600 * (post-bronchodilatátor) * * 400 200 Tiotropium után * * * 0 -200 -400 -600 -800 * FEV1 FVC Áramlás IC * TGV Térfogat *P<0.01, *P<0.001 versus placebo Celli B et al. Chest 2003 124:1743-1749 Az életminőség (SGRQ score) javulása egy éves tiotropium kezelés alatt COPD-ben (vs. Ipratropium) Ipratropium (n=159) 46 Tiotropium (n=327) 44 T-I 3,3 42 * Javulás SGRQ score Bazális * 40 * * 38 *p<0,05 *p<0,01 8 50 92 182 273 364 Napok Vincken W et al. Eur REspir J (2002) Exacerbációk száma/beteg/év Egy éves tiotropium kezelés hatása az exacerbációk incidenciájára COPD-ben (vs. Placebo) p=0,045 1,2 1,0 0,95 20% 0,8 0,76
0,6 0,4 0,2 0,0 Placebo (n=371) Tiotropium (n=550) Casaburi R et al. Eur Respir J (2002) Hospitalizációk száma/beteg/év Egy éves tiotropium kezelés hatása COPD-ben az exacerbációk miatti hospitalizációra (vs. Placebo) p=0,019 0,20 0,16 44% 0,15 0,09 0,10 0,05 0,00 Placebo (n=371) Tiotropium (n=550) Casaburi R et al. Eur Respir J (2002) Antibiotikum-választás a COPD akut exacerbációjában Klinikai állapot Patogének Antibiotikumok I.stádium Enyhe M.catarrhalis S.pneumoniae (penicillin/makrolid rezisztens) aminopenicillin/klavulánsav ampicillin/sulbactam II.,IIIgen cefalosporinok új makrolidok II.stádium Középsúlyos „ „ (penicillin/makrolid rezisztens) vagy respirációs kinolonok? III.stádium Súlyos „ + penicillin +makrolid rezisztens pneumococcusok IV.stádium Nagyon súlyos „ + Gram negatív bélbaktériumok „ vagy respirációs kinolonok respirációs kinolonok (pseudomonas aeruginosa infekció esetén
ciprofloxacin) Antibiotikum-választás a COPD akut exacerbációjában Klinikai állapot Patogének Antibiotikumok I.stádium Enyhe M.catarrhalis S.pneumoniae (penicillin/makrolid rezisztens) aminopenicillin/klavulánsav ampicillin/sulbactam II.,IIIgen cefalosporinok új makrolidok II.stádium Középsúlyos „ „ (penicillin/makrolid rezisztens) vagy respirációs kinolonok? III.stádium Súlyos „ + penicillin +makrolid rezisztens pneumococcusok IV.stádium Nagyon súlyos „ + Gram negatív bélbaktériumok „ vagy respirációs kinolonok respirációs kinolonok (pseudomonas aeruginosa infekció esetén ciprofloxacin) ICS+LABA kombinációs kezelés gyulladáscsökkentő hatása stabil (GOLD II-III. fokozat) COPD-ben Javulás Placebo Javulás SALM/FP Bronchialis biopsziás anyag ΔFEV1 (L) SALM/FP 50/500 vs.Placebo Hetek . Barnes N, et al 2006 AJRCCM Előrelépés a COPD kezelésében Új, a túlélést javító terápiás módok bevezetése
szükséges : − Az exacerbációk hatásosabb megelőzése és kezelése − Hatékonyabb dohányzást felfüggesztő stratégiák − Gyulladáscsökkentő, célzott (a betegség valamennyi komponensére ható) farmakóterápia − Nem farmakóterápiás kezelések ( pulmonális rehabilitáció, non-invazív lélegeztetés) beépítése az egész életen át tartó kezelésbe Az oxigén-kezelés rizikója COPD-ben CO2-retenció (akut COPD-ben gyakoribb) mechanizmusai • CO2-vel szembeni szenzititivitás csökkenése/hiánya (a ventiláció hajtóereje ilyenkor a hypoxaemia) • Hypoxiás vasoconstrictio csökkenése − a véráramlás (Q) az alacsony V/Q rátájú régiokban (funkcionáli shunt) − a véráramlás (Q) ↓ a magas V/Q rátájú régiókban Absorpciós atelektázia Oxigén-toxicitás Ha az FI,O2 35-40% a CO2-retenció ritka Egészségi állapot Az egészségi állapot megállapítását kérdőívek standardizálják. Ezek alkalmasak betegcsoportoknál
a javulás monitorozására terápiás intervenciók (pl. farmakoterápia) vagy pulmonalis rehabilitáció esetén A COPD kezelésének egyik célja a az egészségi állapot javítása, ami a tünetek csökkenéséből, a terhelési tolerancia növekedéséből ,az exacerbációk csökkenéséből, az alvásminőség javulásából következik