A doksi online olvasásához kérlek jelentkezz be!
A doksi online olvasásához kérlek jelentkezz be!
Nincs még értékelés. Legyél Te az első!
Tartalmi kivonat
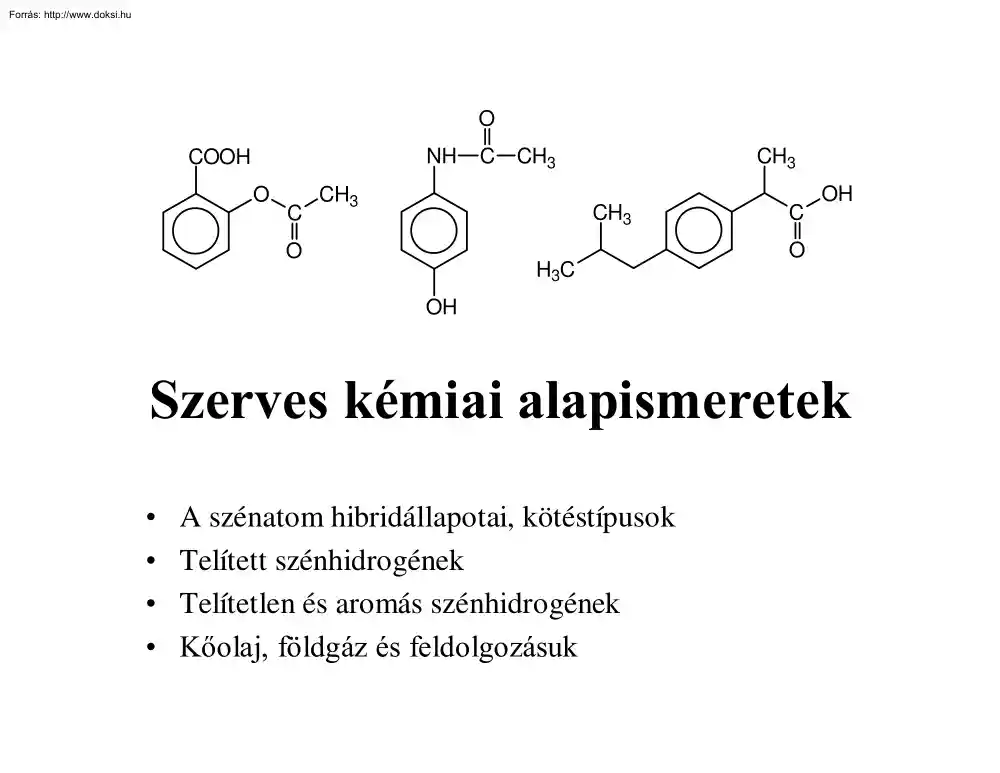
O NH COOH O C C CH3 CH3 CH3 CH3 O H3C C OH O OH Szerves kémiai alapismeretek • A szénatom hibridállapotai, kötéstípusok • Telített szénhidrogének • Telítetlen és aromás szénhidrogének • Kőol a j ,f öl dgá zé sf e l dol goz á s uk A szénatom és tulajdonságai • As z é ne l e miá l l a pot b a ni se l őf or dulat e r mé s z e t b e n( gr a f i té s gyémánt: atomrácsos szerkezet). • A szénatomok egymással vegyületekben is (szinte) korlátlan számban összekapcsolódhatnak. • A szén helye a periódusos rendszerben: 2. periódus, IV oszlop • Elektronegativitás: 2,5 • Elektronszerkezet: 1s22s22p2 • Az alapállapotú szénatomban két párosítatlan elektron van, e nn e ke l l e n é r en e mke t t ő,h a ne má l t a l á b a nn é gykov a l e ns kötést létesít. Magyarázat: hibridizáció Hibridizáció • 1 db s-pálya és 3 db p-pálya kombinációjával 4 db - azonos e n e r gi a s z i n t ű-
hibridpályához jutunk: sp3 hibridállapot. Hibridállapotok H 109,5° s + px + py + pz sp3 C H H H metán tetraéder alak ~120° H H C s + px + py + pz sp2 H C H etilén sík molekula 180° H C C H s + px + py + pz sp acetilén lineáris molekula A vegyületcsoportok tárgyalása: •Szerkezet, elnevezés •Fizikai tulajdonságok •Kémiai tulajdonságok •El ő f o r dul á s ,g y a ko r l a t ij e l e nt ő s é g ,né há ny példa, érdekességek Mit kell tudni a vizsgán? •Aze l ő a dá s o ns z e r e pl ővegyületek szerkezeti ké pl e t eé sne ve ,j e l e nt ő s é g e •J e l l e mz őreakciótípusok egy-egy példával Szénhidrogének Csak szénatomokból és hidrogénatomokból állnak. • Telített szénhidrogének (csak egyszeres kötést tartalmaznak): Alkánok (nyílt láncú) és cikloalkánok ( gy űr űs ) • Telítetlen szénhidrogének: Alkének (egy C=C kétszeres kötést tartalmaznak) Diének (két C=C kétszeres kötést
tartalmaznak). Alkinok (egy CC háromszoros kötést tartalmaznak) • Aromás szénhidrogének (aromás szerkezet: 4n+2 -elektron de l oka l i z á l tköt é s e ke ta l kot ,e gys í kb a ne l he l y e z ke dő s z é n a t omokgy űr űb ez á r ódn a k) Alkánok (Parafinok) Szerkezet • Összegképlet CnH2n+2 • Homológ sor: metán etán propán bután pentán CH4 C2H6 CH3CH3 C3H8 CH3CH2CH3 C4H10 CH3(CH2)2CH3 C5H12 CH3(CH2)3CH3 hexán heptán oktán nonán dekán undekán . C6H14 C7H16 C8H18 C9H20 C10H22 C11H24 CH3(CH2)4CH3 CH3(CH2)5CH3 CH3(CH2)6CH3 CH3(CH2)7CH3 CH3(CH2)8CH3 CH3(CH2)9CH3 • Elnevezés: -á nv é gz ődé s A butánig a triviális neveket használjuk, a pentántól kezdve a nevet a s z é n a t o ms z á mg ö r ö gme gf e l e l ő j é bő lké pe z z ük .Aza l k á no ke l ne v e z é s e a szisztematikus (IUPAC szerinti) nevezéktan alapja. Alkánok Szerkezet • Térszerkezet, szerkezeti képletek H etán propán CH4 C H H H H H
H C C H H H metán H HH H H C C C CH3 CH3 CH3 CH2 CH3 H H H HH H H bután H C C C C H H H H H CH3 CH2 CH2 CH3 I z omé r i a:az onosös s z e gké pl e t ,e l t é r ős z e r ke z e t • Konstitúció: az atomok kapcsolódási sorrendje. • Kons t i t úc i ósi z omé r i a :a za t omokka pc s ol ódá s ae l t é r ő. Négy szénatomból álló váznál már fellép az izoméria: CH3 CH2 CH2 CH3 n-bután CH3 CH3 CH CH3 i-bután 2-metil-propán • Az izomerek fizikai és kémiai tulajdonságai kisebb-nagyobb mértékben eltérnek egymástól. Elnevezés • Alkánból egy hidrogénatom (képzeletbeli) eltávolításával alkilcsoportot (alkilgyököt) kapunk: CH4 metán CH3 metil csoport CH3CH3 etán CH3CH2 etil csoport CH3CH2CH2 CH3CH2CH3 n-propil csoport propán CH3CHCH3 i-propil csoport A szénatom r e ndűs é ge : az adott szénatomhoz kapcsolódó szénatomok száma. s odr e n dű h a r ma dr e n dű má (szekunder) (tercier) CH3 CH3
CH3 CH CH2 C CH3 e l s őr e n dű (primer) CH3 n e gy e dr e n dű (kvaterner) Alkánok Fizikai tulajdonságok • Olvadáspont, forráspont a szénatomszám növekedésével e me l ke di k.Sz ob a h őmé r s é kl e t e nC1-C4 (színtelen, szagtalan) gáz, C5-C19 (színtelen, jellegzetes szagú) folyadék, >C20 szilárd halmazállapotúak. • Apoláros molekulák (EN = EN(C)-EN(H) = 2,5-2,1 = 0,4; a C-H kötés enyhén poláros, de a molekulák szimmetriája miatt a töltéseloszlás egyenletes). • Apoláros oldószerekben oldódnak, egymással elegyednek. • Ví z b e nn e mol dódn a k,ki s e bbs űr űs é gükmi a t taví zf e l s z í né n helyezkednek el. Alkánok Kémiai tulajdonságok • Sz ob a h őmé r s é kl e t e nke v é s s ér e a kc i óké pe s e k( parum affinis), innen kapták régi nevüket: parafinok. • Oxi gé nj e l e nl é t é be ne l é ge t h e t ők: CnH2n+2 + (3n+1)/2 O2 = n CO2 + (n+1) H2O CH4 + 2 O2 = CO2 + 2 H2O •
Halogénekkel (Cl2, Br2) gyökös mechanizmusú szubsztitúciós (helyettesítési) reakcióba lépnek (lásd láncreakciók!): CH4 + Cl2 = CH3Cl + HCl CH3Cl + Cl2 = CH2Cl2 + HCl (. CHCl3 CCl4) Ar e a kc i óf é nyha t á s á r amá rs z ob a h őmé r s é kl e t e ni sl e j á t s z ódh a t . Alkánok Kémiai tulajdonságok • Hőbont ásv. kr akkol ás(crack - t ör ) :ma ga sh őmé r s é kl e t e n (500°C felett) a C–C kötések felszakadnak, és kisebb részletek szakadnak ki: R CH 2 CH 2 CH 3 R CH 3 + CH2 CH2 Kr a kkol á s s a lgy űr űsv e gy ül e t e k( c i kl oa l ká n oké sa r omá s v e gy ül e t e k)i se l őá l l í t h a t ókar e a kc i ókör ül mé ny e k ( h őmé r s é kl e t ,ny omá s ,ka t a l i z á t or )me gf e l e l őb e á l l í t á s á va l . A vegyiparban f őké n ta l a pa ny a gok( etilén, propilén, butadién, aromás vegyületek)e l őá l l í t á s á r aa l ka l ma z z á ka krakkolást. Alkánok El ő f o r
dul á s ,f e l ha s z nál ás • Földgáz:f ő k é ntk i ss z é na t o ms z á múa l ká no ka l ko t j á k . Ma g y a r o r s z á g o na f ö l d g á zl e g n a g y o b br é s z eme t á n.Ame t á ntf űt é s r e , h i d r o g é ne l ő á l lítására (pl. a mmó n i a s z i n t é z i s he z ) ,a c e t i l é ne l ő á l l í t á s á r aha s z ná l j á k . Ame t á nszíntelen, s z a g t a l a ng á z , l e v e gőv e lke ve r e dv er o bb a nó e l e gy e tk é p e z .Af ö l d g ázhoz kéntartalmú vegyületeket kevernek, hogy ezek szaga elárulja a szivárgást. • Kő o l a j : alkánokon kívül cikloalkánok, aromás vegyületek, heterociklusos v e gy ü l e t e ki st a l á l ha t ó kb e nne .Akő o l a j a tf r a kc i o ná l td e s z t i l l á cióval dolgozzák fel. A desztilláció termékei: • oldott gázok (C3, C4) - PB gázpalackok töltésére használják •k ö n ny ű - és nehézbenzin (C5 - C9) - oldószerek, motorbenzin • petróleum
(világítóolaj) (C10 - C12) - kerozin • gázolaj (C13 - C15) - üzemanyag •k e nő o l a j o k( C16 - C28) • pakura - f ű t ő a ny a g,k r a kk o l á s ia l a pa ny a g • aszfalt - rugalmas útburkoló anyag alkotórésze Mot or haj t óa nyagokmi nős í t é s e • Oktánszám: amo t o r b e nz i nko mp r e s s z i ó t ű r é s é ne kj e l l e mz é s é r eha s z n á l j á k . Az oktánszám annak a n-heptán –i-oktán (2,2,4-trimetil-pentán) elegynek a százalékban kifejezett i-o kt á nt a r t a l ma ,a me l y ne kko mp r e s s z i ó t ű r é s ea vizsgált benzinével megegyezik. CH3 CH3 CH3(CH2)5CH3 CH3 C CH2 CH CH3 CH3 n-heptán i-oktán • Cetánszám: a gázolaj öngyulladási hajlamának jellemzésére szolgál. A cetánszám annak a cetán (n-hexadekán) –-metil-naftalin elegynek a százalékban kifejezett cetántartalma, amelynek öngyulladási képessége a vizsgált gázolajéval azonos. CH3 CH3(CH2)14CH3 cetán
-metil-naftalin Tengeri olajszennyezés Évente többmillió tonna nyersolaj kerülhet a tengerbe (ennek kb. 10%-a tartályhajók bal es et ei nekkövet kez ménye,at öbbia„ nor mál i s ” működés s elj ár ) 1400 3 •10 t / év 1200 1000 800 600 400 200 0 tanker balesetek olajkutak "lefolyóból" "normális" (fáradtolaj, működés e üzemanyag) f üs t ből ki ül epedő szárazföldi olajkutak természetes szivárgás Kőol ajsorsa a tengerben: •nagy felületen szétterül •kisebb szénatomszámú alkotórészek elpárolognak (kb. 25%, 1 hét alatt) •el nem ágazó szénláncú alkánok: biológiai úton lebomlanak (kb. 30%) •kb. 5% oldódik a tengervízben, ugyanennyi fotokémiai oxidációval bomlik le •kb. 15% lesüllyed a tengerfenékre •kb.20% hos s z úi dei gaf el s z í nenmar ad( t öbbgy űr űsar omás vegyületek, cikloalkánok, kátrány), ezek a leginkább mér gez őek! Az olajszennyezés hatásai az él
ővi l ágr a: •s z űk t űr és űf aj okpus zt ul ás a • olajpestis: vízre leszálló madarakat pusztítja el •a tollakat borító zsiradék feloldódik, a madár egyre kevésbé tud fennmaradni a vízen ill. repülni (vagyis táplálékot szerezni, menekülni) •a hős z i get el éskár os odásami at tazanyagc ser ef okoz ódi k,ez végkimerüléshez vezet •a t ol l ai tt i s z t ogat nii gyekvőmadárazolajat egyre jobban szétkeni a t est én,egyr ész étl enyel i( mér gez és:vese,májésemész t őr endsz er károsodása) Cikloalkánok Szerkezet • Összegképlet CnH2n CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 ciklopropán ciklobután ciklopentán ciklohexán • Elnevezés: ugyanúgy történik, mint az alkánok esetében, a za l a pv á z n a kme gf e l e l ős z é n a t oms z á múa l ká nn e v é h e za ciklo- szócskát illesztjük. Cikloalkánok Térszerkezet ciklopropán H H ciklobután ciklopentán
ciklohexán H 60° H H H szék kád ciklobután ciklopentán ciklohexán (szék) Alkének (Olefinek) Szerkezet • Összegképlet CnH2n • Homológ sor: etén (etilén) C2H4 propén C3H6 but-1-én C4H8 pent-1-én C5H10 CH2=CH2 CH2=CH–CH3 CH2=CH–CH2–CH3 CH2=CH–(CH2)2CH3 etenil (vinil) csoport propenil (allil) csoport CH2=CH– CH2=CH– CH2– • Elnevezés: -é nv é gz ődé s ,e l őt t eake t t ős k öt é sh e l y é tj e l z ő s z á mma l .( Új a bbl e h e t ős é gi z omé r i á r a ! ) but-1-én but-2-én pent-1-én pent-2-én CH2=CH–CH2– CH3 CH3–CH=CH– CH3 CH2=CH–(CH2)2– CH3 CH3– CH=CH–CH2–CH3 Alkének Szerkezet • Té r s z e r ke z e t :aké t s z e r e sk öt é s b e nr é s z tv e v ős z é na t omok sp2 hibridállapotúak, a hozzájuk kapcsolódó atomokkal egy síkban helyezkednek el, amely egyben a -kötés csomósíkja. A -kötés elektronjai a sík alatt és felett tartózkodhatnak. H H C C H H •
A -kötés körül nem lehetséges elfordulás, ez újabb izoméria fellépésével jár (cisz-transz vagy (E)-(Z) izoméria). Alkének • cisz-transz vagy (E)-(Z) izoméria H3 C CH3 C H H3 C H C C H cisz-but-2-én (Z)-but-2-én H C CH3 transz-but-2-én (E)-but-2-én Azi z ome r e kf i z i ka ié ské mi a it ul a j don s á ga ie l t é r őe k. Alkének Fizikai tulajdonságok • A molekulák apolárosak, így a fizikai tulajdonságok (olvadáspont, forráspont, oldékonyság) az alkánokéhoz hasonlóak. Kémiai tulajdonságok • A -köt é smi a t ta za l ké n e kj óv a lr e a kc i óké pe s e bb e k.J e l l e mz ő reakciójuk az elektrofil addíció (AE). Olefin ( ol a j ké pz ő)e l n e ve z é se r e de t e : CH2=CH2 + Cl2 Cl–CH2–CH2–Cl (1,2-diklór-e t á n ,ol a j s z e r ű) • Ake t t ősk öt é shi dr ogé nn e lt e l í t h e t őka t a l i z á t orj e l e nl é t é b e n . • Az alkének molekulái egymással hosszú láncokká
(makromolekulákká) kapcsolódhatnak össze (polimerizáció). Elektrofil addíció - etilén reakciója brómmal: CH2=CH2 + Br2 Br–CH2–CH2–Br 1,2-dibróm-etán - propén reakciója hidrogén-kloriddal: CH2 CH CH3 + HCl CH3 CH CH3 Cl 2-klór-propán - etilén reakciója vízzel: CH2=CH2 + H–OH CH3–CH2–OH etanol (etil-alkohol) Katalitikus hidrogénezés C + H2 C kat. H C C H katalizátorok: Pt, Pd, Ni Polimerizáció n C C C C C C m Vinilpolimerek monomer polimer név CH2 CH2 CH2 CH2 m polietilén CH2 CHCH3 CH2 CH polipropilén m CH3 CH2 CHCl CH2 CH m CH2 CHCN CH2 Cl CH poli-vinil-klorid (PVC) m CF2 CF2 CF2 C N CF2 m poli-akril-nitril (orlon) CH2 CH CH2 CH CH3 CH2 C CH3 O C m poli-tetrafluoretilén (teflon) poli-sztirol poli-metil-metakrilát (plexi) C OCH3 CH2 C OCH3 O m Fontosabb alkének • Etén (etilén): ak őol a jbe n z i n f r a k c i ó j á n a kk r a kko l á s á va lá l l í t j á ke l ő(
800900° Ch őmé r s é kl e t e n ) .Sz á mo sve gyi pa r ie l j á r á s ,k öz t ükapo l i e t i lén gy á r t á s á n a ka l a p a n y a g a .Aze t i l é nat e r mé s z e t be ni se l őf o r d ul ,a növények érést szabályozó hormona. • Propén (propilén): krakkolási melléktermék. Polipropilén, propán-2-ol, izopropil-be n z ol( k umol )e l ő á l l í t á s á n a ka l a p a n y a g a . • 2-metil-propén (izobutilén): krakkolási melléktermék. Magas ok t á n s z á mús z i n t e t i k uspol i me r be nz i né si z o pr é n( l .di é ne k)e l ő á llítására is használják. • Pentének: ak r a k kol á ss o r á nke l e t ke z ne k ,i z o pr é ne l ő á l l í t á s á r a használhatók. Diének (Diolefinek) Szerkezet • Összegképlet CnH2n-2 • Homológ sor (az elnevezés az alkénekével analóg): C3H4 CH2=C=CH2 propadién (allén) C4H6 CH2=C=CH– CH3 buta-1,2-dién buta-1,3-dién (butadién) C4H6 CH2=CH– CH=CH2 penta-1,2-dién
C5H8 CH2=C=CH–CH2CH3 penta-1,3-dién C5H8 CH2=CH–CH=CH–CH3 penta-1,4-dién C5H8 CH2=CH– CH2– CH=CH2 . Eg y r et ö b bal e he t ő s é ga zi z o mé r i av á l t o z a t o sf o r má i na kf e l l é p é s ére! propadién (allén) Diének Egyéb diének CH3 CH2 C CH CH2 2-metil-buta-1,3-dién (izoprén) ciklopenta-1,3-dién ciklohexa-1,4-dién Diének Fizikai tulajdonságok: az alkénekéhez hasonlóak. Kémiai tulajdonságok: a za l ké n e kh e zh a s onl óa nj e l l e mz ő r e a kc i ój uka ze l e kt r of i la ddí c i ó,hi dr ogé n e z h e t ők ,hi dr oxi l e z h e t ők, oxidálhatók és polimerizálhatók is. Fontosabb diének • Butadién (buta-1,3-dién): krakkolással és bután dehidrogénezésével gy á r t j á k .Fő l e gs z i n t e t i k usk a uc s uke l ő á l l í t á s á r ah a s z n á l j á k . • Izoprén (2-metil-buta-1,3-dién): a gumi monomerje. A kaucsukfa nedve l i ne á r i spol i i z o pr é n tt a r t a l ma z( e zk
b.40000i z o pr é ne gy s é g bő lá ll). A kaucsukból vulkanizálással térhálós polimert készítenek: a kaucsukot ké nn e lme l e gí t i k ,e kko ral á n c o k ba nl é vőke t t ő skö t é s e kf e l s z a k a dnak, és a láncok kénhidakkal összekapcsolódnak. Napjainkban a gumigyártás alapanyaga már jórészt szintetikus izoprén. • Kloroprén (2-klór-buta-1,3-dién): polimerizációjával készül a neoprén, a me l ye tví z h a t l a né shő s z i ge t e l őr uh á kké s z í t é s é r eh a s z n á l n a k . I z opr é ne gys é ge kbőlf e l é pül őt e r mé s z e t e sanyagok OH OH geraniol (a rózsaolaj alkotórésze) mentol (a borsmentaolaj alkotórésze) likopin -karotin Alkinek (acetilén-szénhidrogének) Szerkezet • Összegképlet CnH2n-2 • Homológ sor: etin (acetilén) C2H2 propin C3H4 but-1-in C4H6 pent-1-in C5H8 CHCH CHC– CH3 CHC– CH2– CH3 CHC– (CH2)2– CH3 etinil csoport CHC– •
Elnevezés: -i nv é gz ődé s ,e l őt t eah á r ma sköt é sh e l y é tj e l z ő számmal. but-1-in but-2-in pent-1-in pent-2-in CHC– CH2–CH3 CH3–CC– CH3 CHC– (CH2)2–CH3 CH3– CC– CH2–CH3 Alkinek Szerkezet • Té r s z e r ke z e t :ah á r oms z or osk öt é s b e nr é s z tv e v ős z é n a t omok sp hibridállapotúak, a hozzájuk kapcsolódó atomokkal egy vonal mentén helyezkednek el. A két -kötésnek két, e gy má s r ame r ől e ge sc s omós í kj av a n . 180° H C C H H C C H Alkinek Fizikai tulajdonságok • A molekulák apolárosak, így a fizikai tulajdonságok (olvadáspont, forráspont, oldékonyság) az alkánokéhoz, alkénekéhez hasonlóak. Kémiai tulajdonságok • A két -kötés miatt az alkinek igen reakcióképesek. • Ah á r ma sköt é s b e nr é s z tv e v ős z é n a t omh ozka pc s ol ódó hidrogénatom protonként lehasítható, az alkinek ezért savas jelleget mutatnak. (A víznél
azonban jóval gyengébb savak, így savas jellegük vizes oldatban nem vizsgálható, folyékony ammóniában azonban igen.) • Aza l ki ne kgy a kor l a t is z e mpon t b óll e gf on t os a bbké pvi s e l őj ea z acetilén (etin). Acetilén (etin) Fizikai tulajdonságok • Aza c e t i l é nal e v e gőn é lki s s ékönny e bb ,s z í n t e l e n ,t i s z t a állapotban szagtalan gáz. Vízben nem, acetonban jól oldódik (A hegesztéshez használt disszugáz (dissous = oldott) palackban acetonnal átitatott kovaföld van, ebben nyeletik el az acetilént. Erre azért van szükség, mert az acetilén nyomással nem cseppfolyósítható, felrobbanna.) El őál l í t ás • Me t á nv a gyakőol a jkönny űb e n z i n -frakciójának krakkolásával gyártják 1500-2500° Ch őmé r s é kl e t e n . • Kor á bb a né ge t e t tmé s z b őle l őá l l í t ot tka l c i um-karbid vízzel való reakciójával nyerték: CaO + 3 C = CaC2 + CO CaC2 + 2 H2O = C2H2 +
Ca(OH)2 Sav-bázis reakció: a víz - mi nte r ő s e b bs a v- az acetilént - mint gyengébb savat sójából felszabadítja (ez a karbidlámpa műkö dé s é ne ka l a p j ai s ) . Acetilén (etin) Felhasználás • Aza c e t i l é nl e v e gőnvi l á gí t ó,k or moz ól á n gga lé g( an a gy széntartalom miatt nem tökéletes az égés). Oxigénnel keverve t öké l e t e s e ne l é ge t h e t ő,l á n gj ama ga sh őmé r s é kl e t ű,h e ge s z t é s r e használható. • Az 1930-as években dolgozták ki Németországban azokat az eljárásokat (Reppe-s z i n t é z i s e k) ,a me l y e kke la c e t i l é nb ől műb e n z i n t ,műa ny a gi pa r ia l a pa ny a goka tá l l í t ot t a ke l ő. CH CH + HCl CH2 CH Cl vinil-klorid CH CH + H2O CH2 CH OH vinil-alkohol CH3 CH O acetaldehid Aromás vegyületek Alapvegyület: a benzol • Összegképlet C6H6 - telítetlenségre utal, a kémiai tulajdonságok viszont ennek ellentmondanak: nem
addíciós, hanem szubsztitúciós reakciókra hajlamos! •J e l l e gz e t e ss z a gú,ví z z e ln e me l e gy e dő,v í z n é lki s e bb s űr űs é gűf ol y a dé k. • Súl y os a nmé r ge z ő,r á kke l t őa ny a g. A benzolt M. Faraday fedezte fel 1825-b e nab á l n a z s í rhő b o nt á s á n a k termékei között. A látszólagos telítetlenség és a kémiai viselkedés ellentmondásai miatt sok kutató próbálkozott a benzol szerkezetének felírásával (amikor a szénatom négy vegyértékét már ismerték, de az a t o ms z e r k e z e t r ő lmé gne ml e he t t e ki s me r e t e i k ) .A Kekulé von Stradonitz 1865-b e nf e l i s me r t eab e nz o lgy űr űss z e r ke z e t é t .El mé l e t é ne khe l y e s s é gét c s a k ne m s z á zé v ve l ké s ő bb a r ö nt ge nd i f f r a k c i ó ss z e r k e z e t v i z s g á l a t igazolta. Aromás vegyületek A benzol szerkezete • A szénatomok sp2 hibridállapotúak. A kötésszögek
értéke 120° • A -kötések felírása után minden szénatomnak marad egy p-e l e kt r onj a ,a me l y e kb őlagy űr űs í kj aa l a t té sf e l e t tde l oka l i z á l t -k öt őpá l y á ka l a kul na kki . H H H C C C C H C C H H H H H H H H H H H H H H Aromás vegyületek Az aromás szerkezet szimmetrikus, igen stabil, nehezen megbontható, ez a szokatlan kémiai stabilitás háttere. Az aromás szerkezet kialakulásának feltételei: • agy űr űa t omj a ie gys í kb a nva nn a k • Hückel-szabály: a -elektronok száma: 4n + 2 (n = 1, 2, 3.) elnyelés a közeli UV tartományban A benzol UV spektruma Aromás vegyületek A benzol szerkezetének jelölése vonalképletekkel: Kekulé-képlet Vigyázat! ciklohexán Robinson-képlet: "hatszögbe írt kör" Aromás vegyületek Cl Szubsztituált benzolszármazékok CH3 CH3 CH3 klórbenzol CH3 NO2 toluol (metil-benzol) CH3 CH3 o-xilol m-xilol (1,2-dimetil-benzol)
(1,3-dimetil-benzol) CH CH2 CH3 nitrobenzol CH CH3 CH3 O2N CH3 sztirol (vinil-benzol) p-xilol (1,4-dimetil-benzol) kumol (izopropil-benzol) NO2 NO2 2,4,6-trinitro-toluol (TNT, trotil) Aromás vegyületek Be nz ol b óll e v e z e t h e t őc s op or t ok( gy ökök ) C6H5 C6H4 C6H4 fenil csoport p-fenilén csoport o-fenilén csoport CH2 benzil csoport Többar omásgyűr űtt ar t al maz ór e nds z e r e k Kon de n z á l tgy űr űspol i a r omá sv e gy ül e t e k naftalin pirén antracén benzpirén PAH = polyaromatic hydrocarbon fenantrén Többar omásgyűr űtt ar t al maz ór e nds z e r e k I z ol á l tgy űr űspol i a r omá sv e gy ül e t e k Cl Cl Cl bifenil Cl 3,3',4,4'-tetraklór-bifenil (egy gyakori PCB) PCB = polychlorinated biphenyl Cl O Cl Cl O Cl dioxin, TCDD (2,3,7,8-tetraklór-dibenzo-p-dioxin, a 2,4-D és a 2,4,5-T gyomirtók gyártásának mellékterméke) A benzol (és az aromás vegyületek) kémiai
tulajdonságai • A benzol katalitikus hidrogénezése ciklohexánhoz vezet: H2 (PtO2) • Brómmal (vas katalizátor jelenlétében) és salétromsavval (kénsav jelenlétében) elektrofil szubsztitúció játszódik le: H Br Br2 (Fe) H + HBr NO2 HONO2 (H2SO4) + H2O Fontosabb aromás vegyületek • Benzol:r é ge nakős z é n ká t r á nyl e pá r l á s á v a lny e r t é k,maf ől e ga b e n z i nf r a kc i ókr a kkol á s á va lá l l í t j á ke l ő.Er ős e nr á kke l t ő,ki s koncentrációban is leukémiát okozhat. Felhasználása s z é l e s kör ű:ol dós z e r ,v e gy i pa r ie l j á r á s oka l a pa ny a ga ,ok t á n s z á m növelésére alkalmas adalék. • Toluol, xilolok: krakkoláskor keletkeznek a benzol mellett. Ke v é s b év e s z é l y e s e k,ol dós z e r ké n t( , , a r omá shí gí t ó” )é s motorbenzin-a da l é kké n th a s z ná l j á kőke t . • 2,4,6-trinitro-toluol (TNT, trotil): nagy hatású robbanóanyag.
Használata viszonylag biztonságos, mert ütésre, rázásra nem robban. • Poliaromás szénhidrogének (PAH-ok): nem tökéletes égéskor keletkeznek (pl. dohányfüst, pirított kenyér, füstölt áruk) Rá kke l t ő,mut a gé nh a t á s úa ny a goki ge nki sme nnyi s é gbe ni s . Köszönöm a figyelmet!
hibridpályához jutunk: sp3 hibridállapot. Hibridállapotok H 109,5° s + px + py + pz sp3 C H H H metán tetraéder alak ~120° H H C s + px + py + pz sp2 H C H etilén sík molekula 180° H C C H s + px + py + pz sp acetilén lineáris molekula A vegyületcsoportok tárgyalása: •Szerkezet, elnevezés •Fizikai tulajdonságok •Kémiai tulajdonságok •El ő f o r dul á s ,g y a ko r l a t ij e l e nt ő s é g ,né há ny példa, érdekességek Mit kell tudni a vizsgán? •Aze l ő a dá s o ns z e r e pl ővegyületek szerkezeti ké pl e t eé sne ve ,j e l e nt ő s é g e •J e l l e mz őreakciótípusok egy-egy példával Szénhidrogének Csak szénatomokból és hidrogénatomokból állnak. • Telített szénhidrogének (csak egyszeres kötést tartalmaznak): Alkánok (nyílt láncú) és cikloalkánok ( gy űr űs ) • Telítetlen szénhidrogének: Alkének (egy C=C kétszeres kötést tartalmaznak) Diének (két C=C kétszeres kötést
tartalmaznak). Alkinok (egy CC háromszoros kötést tartalmaznak) • Aromás szénhidrogének (aromás szerkezet: 4n+2 -elektron de l oka l i z á l tköt é s e ke ta l kot ,e gys í kb a ne l he l y e z ke dő s z é n a t omokgy űr űb ez á r ódn a k) Alkánok (Parafinok) Szerkezet • Összegképlet CnH2n+2 • Homológ sor: metán etán propán bután pentán CH4 C2H6 CH3CH3 C3H8 CH3CH2CH3 C4H10 CH3(CH2)2CH3 C5H12 CH3(CH2)3CH3 hexán heptán oktán nonán dekán undekán . C6H14 C7H16 C8H18 C9H20 C10H22 C11H24 CH3(CH2)4CH3 CH3(CH2)5CH3 CH3(CH2)6CH3 CH3(CH2)7CH3 CH3(CH2)8CH3 CH3(CH2)9CH3 • Elnevezés: -á nv é gz ődé s A butánig a triviális neveket használjuk, a pentántól kezdve a nevet a s z é n a t o ms z á mg ö r ö gme gf e l e l ő j é bő lké pe z z ük .Aza l k á no ke l ne v e z é s e a szisztematikus (IUPAC szerinti) nevezéktan alapja. Alkánok Szerkezet • Térszerkezet, szerkezeti képletek H etán propán CH4 C H H H H H
H C C H H H metán H HH H H C C C CH3 CH3 CH3 CH2 CH3 H H H HH H H bután H C C C C H H H H H CH3 CH2 CH2 CH3 I z omé r i a:az onosös s z e gké pl e t ,e l t é r ős z e r ke z e t • Konstitúció: az atomok kapcsolódási sorrendje. • Kons t i t úc i ósi z omé r i a :a za t omokka pc s ol ódá s ae l t é r ő. Négy szénatomból álló váznál már fellép az izoméria: CH3 CH2 CH2 CH3 n-bután CH3 CH3 CH CH3 i-bután 2-metil-propán • Az izomerek fizikai és kémiai tulajdonságai kisebb-nagyobb mértékben eltérnek egymástól. Elnevezés • Alkánból egy hidrogénatom (képzeletbeli) eltávolításával alkilcsoportot (alkilgyököt) kapunk: CH4 metán CH3 metil csoport CH3CH3 etán CH3CH2 etil csoport CH3CH2CH2 CH3CH2CH3 n-propil csoport propán CH3CHCH3 i-propil csoport A szénatom r e ndűs é ge : az adott szénatomhoz kapcsolódó szénatomok száma. s odr e n dű h a r ma dr e n dű má (szekunder) (tercier) CH3 CH3
CH3 CH CH2 C CH3 e l s őr e n dű (primer) CH3 n e gy e dr e n dű (kvaterner) Alkánok Fizikai tulajdonságok • Olvadáspont, forráspont a szénatomszám növekedésével e me l ke di k.Sz ob a h őmé r s é kl e t e nC1-C4 (színtelen, szagtalan) gáz, C5-C19 (színtelen, jellegzetes szagú) folyadék, >C20 szilárd halmazállapotúak. • Apoláros molekulák (EN = EN(C)-EN(H) = 2,5-2,1 = 0,4; a C-H kötés enyhén poláros, de a molekulák szimmetriája miatt a töltéseloszlás egyenletes). • Apoláros oldószerekben oldódnak, egymással elegyednek. • Ví z b e nn e mol dódn a k,ki s e bbs űr űs é gükmi a t taví zf e l s z í né n helyezkednek el. Alkánok Kémiai tulajdonságok • Sz ob a h őmé r s é kl e t e nke v é s s ér e a kc i óké pe s e k( parum affinis), innen kapták régi nevüket: parafinok. • Oxi gé nj e l e nl é t é be ne l é ge t h e t ők: CnH2n+2 + (3n+1)/2 O2 = n CO2 + (n+1) H2O CH4 + 2 O2 = CO2 + 2 H2O •
Halogénekkel (Cl2, Br2) gyökös mechanizmusú szubsztitúciós (helyettesítési) reakcióba lépnek (lásd láncreakciók!): CH4 + Cl2 = CH3Cl + HCl CH3Cl + Cl2 = CH2Cl2 + HCl (. CHCl3 CCl4) Ar e a kc i óf é nyha t á s á r amá rs z ob a h őmé r s é kl e t e ni sl e j á t s z ódh a t . Alkánok Kémiai tulajdonságok • Hőbont ásv. kr akkol ás(crack - t ör ) :ma ga sh őmé r s é kl e t e n (500°C felett) a C–C kötések felszakadnak, és kisebb részletek szakadnak ki: R CH 2 CH 2 CH 3 R CH 3 + CH2 CH2 Kr a kkol á s s a lgy űr űsv e gy ül e t e k( c i kl oa l ká n oké sa r omá s v e gy ül e t e k)i se l őá l l í t h a t ókar e a kc i ókör ül mé ny e k ( h őmé r s é kl e t ,ny omá s ,ka t a l i z á t or )me gf e l e l őb e á l l í t á s á va l . A vegyiparban f őké n ta l a pa ny a gok( etilén, propilén, butadién, aromás vegyületek)e l őá l l í t á s á r aa l ka l ma z z á ka krakkolást. Alkánok El ő f o r
dul á s ,f e l ha s z nál ás • Földgáz:f ő k é ntk i ss z é na t o ms z á múa l ká no ka l ko t j á k . Ma g y a r o r s z á g o na f ö l d g á zl e g n a g y o b br é s z eme t á n.Ame t á ntf űt é s r e , h i d r o g é ne l ő á l lítására (pl. a mmó n i a s z i n t é z i s he z ) ,a c e t i l é ne l ő á l l í t á s á r aha s z ná l j á k . Ame t á nszíntelen, s z a g t a l a ng á z , l e v e gőv e lke ve r e dv er o bb a nó e l e gy e tk é p e z .Af ö l d g ázhoz kéntartalmú vegyületeket kevernek, hogy ezek szaga elárulja a szivárgást. • Kő o l a j : alkánokon kívül cikloalkánok, aromás vegyületek, heterociklusos v e gy ü l e t e ki st a l á l ha t ó kb e nne .Akő o l a j a tf r a kc i o ná l td e s z t i l l á cióval dolgozzák fel. A desztilláció termékei: • oldott gázok (C3, C4) - PB gázpalackok töltésére használják •k ö n ny ű - és nehézbenzin (C5 - C9) - oldószerek, motorbenzin • petróleum
(világítóolaj) (C10 - C12) - kerozin • gázolaj (C13 - C15) - üzemanyag •k e nő o l a j o k( C16 - C28) • pakura - f ű t ő a ny a g,k r a kk o l á s ia l a pa ny a g • aszfalt - rugalmas útburkoló anyag alkotórésze Mot or haj t óa nyagokmi nős í t é s e • Oktánszám: amo t o r b e nz i nko mp r e s s z i ó t ű r é s é ne kj e l l e mz é s é r eha s z n á l j á k . Az oktánszám annak a n-heptán –i-oktán (2,2,4-trimetil-pentán) elegynek a százalékban kifejezett i-o kt á nt a r t a l ma ,a me l y ne kko mp r e s s z i ó t ű r é s ea vizsgált benzinével megegyezik. CH3 CH3 CH3(CH2)5CH3 CH3 C CH2 CH CH3 CH3 n-heptán i-oktán • Cetánszám: a gázolaj öngyulladási hajlamának jellemzésére szolgál. A cetánszám annak a cetán (n-hexadekán) –-metil-naftalin elegynek a százalékban kifejezett cetántartalma, amelynek öngyulladási képessége a vizsgált gázolajéval azonos. CH3 CH3(CH2)14CH3 cetán
-metil-naftalin Tengeri olajszennyezés Évente többmillió tonna nyersolaj kerülhet a tengerbe (ennek kb. 10%-a tartályhajók bal es et ei nekkövet kez ménye,at öbbia„ nor mál i s ” működés s elj ár ) 1400 3 •10 t / év 1200 1000 800 600 400 200 0 tanker balesetek olajkutak "lefolyóból" "normális" (fáradtolaj, működés e üzemanyag) f üs t ből ki ül epedő szárazföldi olajkutak természetes szivárgás Kőol ajsorsa a tengerben: •nagy felületen szétterül •kisebb szénatomszámú alkotórészek elpárolognak (kb. 25%, 1 hét alatt) •el nem ágazó szénláncú alkánok: biológiai úton lebomlanak (kb. 30%) •kb. 5% oldódik a tengervízben, ugyanennyi fotokémiai oxidációval bomlik le •kb. 15% lesüllyed a tengerfenékre •kb.20% hos s z úi dei gaf el s z í nenmar ad( t öbbgy űr űsar omás vegyületek, cikloalkánok, kátrány), ezek a leginkább mér gez őek! Az olajszennyezés hatásai az él
ővi l ágr a: •s z űk t űr és űf aj okpus zt ul ás a • olajpestis: vízre leszálló madarakat pusztítja el •a tollakat borító zsiradék feloldódik, a madár egyre kevésbé tud fennmaradni a vízen ill. repülni (vagyis táplálékot szerezni, menekülni) •a hős z i get el éskár os odásami at tazanyagc ser ef okoz ódi k,ez végkimerüléshez vezet •a t ol l ai tt i s z t ogat nii gyekvőmadárazolajat egyre jobban szétkeni a t est én,egyr ész étl enyel i( mér gez és:vese,májésemész t őr endsz er károsodása) Cikloalkánok Szerkezet • Összegképlet CnH2n CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 ciklopropán ciklobután ciklopentán ciklohexán • Elnevezés: ugyanúgy történik, mint az alkánok esetében, a za l a pv á z n a kme gf e l e l ős z é n a t oms z á múa l ká nn e v é h e za ciklo- szócskát illesztjük. Cikloalkánok Térszerkezet ciklopropán H H ciklobután ciklopentán
ciklohexán H 60° H H H szék kád ciklobután ciklopentán ciklohexán (szék) Alkének (Olefinek) Szerkezet • Összegképlet CnH2n • Homológ sor: etén (etilén) C2H4 propén C3H6 but-1-én C4H8 pent-1-én C5H10 CH2=CH2 CH2=CH–CH3 CH2=CH–CH2–CH3 CH2=CH–(CH2)2CH3 etenil (vinil) csoport propenil (allil) csoport CH2=CH– CH2=CH– CH2– • Elnevezés: -é nv é gz ődé s ,e l őt t eake t t ős k öt é sh e l y é tj e l z ő s z á mma l .( Új a bbl e h e t ős é gi z omé r i á r a ! ) but-1-én but-2-én pent-1-én pent-2-én CH2=CH–CH2– CH3 CH3–CH=CH– CH3 CH2=CH–(CH2)2– CH3 CH3– CH=CH–CH2–CH3 Alkének Szerkezet • Té r s z e r ke z e t :aké t s z e r e sk öt é s b e nr é s z tv e v ős z é na t omok sp2 hibridállapotúak, a hozzájuk kapcsolódó atomokkal egy síkban helyezkednek el, amely egyben a -kötés csomósíkja. A -kötés elektronjai a sík alatt és felett tartózkodhatnak. H H C C H H •
A -kötés körül nem lehetséges elfordulás, ez újabb izoméria fellépésével jár (cisz-transz vagy (E)-(Z) izoméria). Alkének • cisz-transz vagy (E)-(Z) izoméria H3 C CH3 C H H3 C H C C H cisz-but-2-én (Z)-but-2-én H C CH3 transz-but-2-én (E)-but-2-én Azi z ome r e kf i z i ka ié ské mi a it ul a j don s á ga ie l t é r őe k. Alkének Fizikai tulajdonságok • A molekulák apolárosak, így a fizikai tulajdonságok (olvadáspont, forráspont, oldékonyság) az alkánokéhoz hasonlóak. Kémiai tulajdonságok • A -köt é smi a t ta za l ké n e kj óv a lr e a kc i óké pe s e bb e k.J e l l e mz ő reakciójuk az elektrofil addíció (AE). Olefin ( ol a j ké pz ő)e l n e ve z é se r e de t e : CH2=CH2 + Cl2 Cl–CH2–CH2–Cl (1,2-diklór-e t á n ,ol a j s z e r ű) • Ake t t ősk öt é shi dr ogé nn e lt e l í t h e t őka t a l i z á t orj e l e nl é t é b e n . • Az alkének molekulái egymással hosszú láncokká
(makromolekulákká) kapcsolódhatnak össze (polimerizáció). Elektrofil addíció - etilén reakciója brómmal: CH2=CH2 + Br2 Br–CH2–CH2–Br 1,2-dibróm-etán - propén reakciója hidrogén-kloriddal: CH2 CH CH3 + HCl CH3 CH CH3 Cl 2-klór-propán - etilén reakciója vízzel: CH2=CH2 + H–OH CH3–CH2–OH etanol (etil-alkohol) Katalitikus hidrogénezés C + H2 C kat. H C C H katalizátorok: Pt, Pd, Ni Polimerizáció n C C C C C C m Vinilpolimerek monomer polimer név CH2 CH2 CH2 CH2 m polietilén CH2 CHCH3 CH2 CH polipropilén m CH3 CH2 CHCl CH2 CH m CH2 CHCN CH2 Cl CH poli-vinil-klorid (PVC) m CF2 CF2 CF2 C N CF2 m poli-akril-nitril (orlon) CH2 CH CH2 CH CH3 CH2 C CH3 O C m poli-tetrafluoretilén (teflon) poli-sztirol poli-metil-metakrilát (plexi) C OCH3 CH2 C OCH3 O m Fontosabb alkének • Etén (etilén): ak őol a jbe n z i n f r a k c i ó j á n a kk r a kko l á s á va lá l l í t j á ke l ő(
800900° Ch őmé r s é kl e t e n ) .Sz á mo sve gyi pa r ie l j á r á s ,k öz t ükapo l i e t i lén gy á r t á s á n a ka l a p a n y a g a .Aze t i l é nat e r mé s z e t be ni se l őf o r d ul ,a növények érést szabályozó hormona. • Propén (propilén): krakkolási melléktermék. Polipropilén, propán-2-ol, izopropil-be n z ol( k umol )e l ő á l l í t á s á n a ka l a p a n y a g a . • 2-metil-propén (izobutilén): krakkolási melléktermék. Magas ok t á n s z á mús z i n t e t i k uspol i me r be nz i né si z o pr é n( l .di é ne k)e l ő á llítására is használják. • Pentének: ak r a k kol á ss o r á nke l e t ke z ne k ,i z o pr é ne l ő á l l í t á s á r a használhatók. Diének (Diolefinek) Szerkezet • Összegképlet CnH2n-2 • Homológ sor (az elnevezés az alkénekével analóg): C3H4 CH2=C=CH2 propadién (allén) C4H6 CH2=C=CH– CH3 buta-1,2-dién buta-1,3-dién (butadién) C4H6 CH2=CH– CH=CH2 penta-1,2-dién
C5H8 CH2=C=CH–CH2CH3 penta-1,3-dién C5H8 CH2=CH–CH=CH–CH3 penta-1,4-dién C5H8 CH2=CH– CH2– CH=CH2 . Eg y r et ö b bal e he t ő s é ga zi z o mé r i av á l t o z a t o sf o r má i na kf e l l é p é s ére! propadién (allén) Diének Egyéb diének CH3 CH2 C CH CH2 2-metil-buta-1,3-dién (izoprén) ciklopenta-1,3-dién ciklohexa-1,4-dién Diének Fizikai tulajdonságok: az alkénekéhez hasonlóak. Kémiai tulajdonságok: a za l ké n e kh e zh a s onl óa nj e l l e mz ő r e a kc i ój uka ze l e kt r of i la ddí c i ó,hi dr ogé n e z h e t ők ,hi dr oxi l e z h e t ők, oxidálhatók és polimerizálhatók is. Fontosabb diének • Butadién (buta-1,3-dién): krakkolással és bután dehidrogénezésével gy á r t j á k .Fő l e gs z i n t e t i k usk a uc s uke l ő á l l í t á s á r ah a s z n á l j á k . • Izoprén (2-metil-buta-1,3-dién): a gumi monomerje. A kaucsukfa nedve l i ne á r i spol i i z o pr é n tt a r t a l ma z( e zk
b.40000i z o pr é ne gy s é g bő lá ll). A kaucsukból vulkanizálással térhálós polimert készítenek: a kaucsukot ké nn e lme l e gí t i k ,e kko ral á n c o k ba nl é vőke t t ő skö t é s e kf e l s z a k a dnak, és a láncok kénhidakkal összekapcsolódnak. Napjainkban a gumigyártás alapanyaga már jórészt szintetikus izoprén. • Kloroprén (2-klór-buta-1,3-dién): polimerizációjával készül a neoprén, a me l ye tví z h a t l a né shő s z i ge t e l őr uh á kké s z í t é s é r eh a s z n á l n a k . I z opr é ne gys é ge kbőlf e l é pül őt e r mé s z e t e sanyagok OH OH geraniol (a rózsaolaj alkotórésze) mentol (a borsmentaolaj alkotórésze) likopin -karotin Alkinek (acetilén-szénhidrogének) Szerkezet • Összegképlet CnH2n-2 • Homológ sor: etin (acetilén) C2H2 propin C3H4 but-1-in C4H6 pent-1-in C5H8 CHCH CHC– CH3 CHC– CH2– CH3 CHC– (CH2)2– CH3 etinil csoport CHC– •
Elnevezés: -i nv é gz ődé s ,e l őt t eah á r ma sköt é sh e l y é tj e l z ő számmal. but-1-in but-2-in pent-1-in pent-2-in CHC– CH2–CH3 CH3–CC– CH3 CHC– (CH2)2–CH3 CH3– CC– CH2–CH3 Alkinek Szerkezet • Té r s z e r ke z e t :ah á r oms z or osk öt é s b e nr é s z tv e v ős z é n a t omok sp hibridállapotúak, a hozzájuk kapcsolódó atomokkal egy vonal mentén helyezkednek el. A két -kötésnek két, e gy má s r ame r ől e ge sc s omós í kj av a n . 180° H C C H H C C H Alkinek Fizikai tulajdonságok • A molekulák apolárosak, így a fizikai tulajdonságok (olvadáspont, forráspont, oldékonyság) az alkánokéhoz, alkénekéhez hasonlóak. Kémiai tulajdonságok • A két -kötés miatt az alkinek igen reakcióképesek. • Ah á r ma sköt é s b e nr é s z tv e v ős z é n a t omh ozka pc s ol ódó hidrogénatom protonként lehasítható, az alkinek ezért savas jelleget mutatnak. (A víznél
azonban jóval gyengébb savak, így savas jellegük vizes oldatban nem vizsgálható, folyékony ammóniában azonban igen.) • Aza l ki ne kgy a kor l a t is z e mpon t b óll e gf on t os a bbké pvi s e l őj ea z acetilén (etin). Acetilén (etin) Fizikai tulajdonságok • Aza c e t i l é nal e v e gőn é lki s s ékönny e bb ,s z í n t e l e n ,t i s z t a állapotban szagtalan gáz. Vízben nem, acetonban jól oldódik (A hegesztéshez használt disszugáz (dissous = oldott) palackban acetonnal átitatott kovaföld van, ebben nyeletik el az acetilént. Erre azért van szükség, mert az acetilén nyomással nem cseppfolyósítható, felrobbanna.) El őál l í t ás • Me t á nv a gyakőol a jkönny űb e n z i n -frakciójának krakkolásával gyártják 1500-2500° Ch őmé r s é kl e t e n . • Kor á bb a né ge t e t tmé s z b őle l őá l l í t ot tka l c i um-karbid vízzel való reakciójával nyerték: CaO + 3 C = CaC2 + CO CaC2 + 2 H2O = C2H2 +
Ca(OH)2 Sav-bázis reakció: a víz - mi nte r ő s e b bs a v- az acetilént - mint gyengébb savat sójából felszabadítja (ez a karbidlámpa műkö dé s é ne ka l a p j ai s ) . Acetilén (etin) Felhasználás • Aza c e t i l é nl e v e gőnvi l á gí t ó,k or moz ól á n gga lé g( an a gy széntartalom miatt nem tökéletes az égés). Oxigénnel keverve t öké l e t e s e ne l é ge t h e t ő,l á n gj ama ga sh őmé r s é kl e t ű,h e ge s z t é s r e használható. • Az 1930-as években dolgozták ki Németországban azokat az eljárásokat (Reppe-s z i n t é z i s e k) ,a me l y e kke la c e t i l é nb ől műb e n z i n t ,műa ny a gi pa r ia l a pa ny a goka tá l l í t ot t a ke l ő. CH CH + HCl CH2 CH Cl vinil-klorid CH CH + H2O CH2 CH OH vinil-alkohol CH3 CH O acetaldehid Aromás vegyületek Alapvegyület: a benzol • Összegképlet C6H6 - telítetlenségre utal, a kémiai tulajdonságok viszont ennek ellentmondanak: nem
addíciós, hanem szubsztitúciós reakciókra hajlamos! •J e l l e gz e t e ss z a gú,ví z z e ln e me l e gy e dő,v í z n é lki s e bb s űr űs é gűf ol y a dé k. • Súl y os a nmé r ge z ő,r á kke l t őa ny a g. A benzolt M. Faraday fedezte fel 1825-b e nab á l n a z s í rhő b o nt á s á n a k termékei között. A látszólagos telítetlenség és a kémiai viselkedés ellentmondásai miatt sok kutató próbálkozott a benzol szerkezetének felírásával (amikor a szénatom négy vegyértékét már ismerték, de az a t o ms z e r k e z e t r ő lmé gne ml e he t t e ki s me r e t e i k ) .A Kekulé von Stradonitz 1865-b e nf e l i s me r t eab e nz o lgy űr űss z e r ke z e t é t .El mé l e t é ne khe l y e s s é gét c s a k ne m s z á zé v ve l ké s ő bb a r ö nt ge nd i f f r a k c i ó ss z e r k e z e t v i z s g á l a t igazolta. Aromás vegyületek A benzol szerkezete • A szénatomok sp2 hibridállapotúak. A kötésszögek
értéke 120° • A -kötések felírása után minden szénatomnak marad egy p-e l e kt r onj a ,a me l y e kb őlagy űr űs í kj aa l a t té sf e l e t tde l oka l i z á l t -k öt őpá l y á ka l a kul na kki . H H H C C C C H C C H H H H H H H H H H H H H H Aromás vegyületek Az aromás szerkezet szimmetrikus, igen stabil, nehezen megbontható, ez a szokatlan kémiai stabilitás háttere. Az aromás szerkezet kialakulásának feltételei: • agy űr űa t omj a ie gys í kb a nva nn a k • Hückel-szabály: a -elektronok száma: 4n + 2 (n = 1, 2, 3.) elnyelés a közeli UV tartományban A benzol UV spektruma Aromás vegyületek A benzol szerkezetének jelölése vonalképletekkel: Kekulé-képlet Vigyázat! ciklohexán Robinson-képlet: "hatszögbe írt kör" Aromás vegyületek Cl Szubsztituált benzolszármazékok CH3 CH3 CH3 klórbenzol CH3 NO2 toluol (metil-benzol) CH3 CH3 o-xilol m-xilol (1,2-dimetil-benzol)
(1,3-dimetil-benzol) CH CH2 CH3 nitrobenzol CH CH3 CH3 O2N CH3 sztirol (vinil-benzol) p-xilol (1,4-dimetil-benzol) kumol (izopropil-benzol) NO2 NO2 2,4,6-trinitro-toluol (TNT, trotil) Aromás vegyületek Be nz ol b óll e v e z e t h e t őc s op or t ok( gy ökök ) C6H5 C6H4 C6H4 fenil csoport p-fenilén csoport o-fenilén csoport CH2 benzil csoport Többar omásgyűr űtt ar t al maz ór e nds z e r e k Kon de n z á l tgy űr űspol i a r omá sv e gy ül e t e k naftalin pirén antracén benzpirén PAH = polyaromatic hydrocarbon fenantrén Többar omásgyűr űtt ar t al maz ór e nds z e r e k I z ol á l tgy űr űspol i a r omá sv e gy ül e t e k Cl Cl Cl bifenil Cl 3,3',4,4'-tetraklór-bifenil (egy gyakori PCB) PCB = polychlorinated biphenyl Cl O Cl Cl O Cl dioxin, TCDD (2,3,7,8-tetraklór-dibenzo-p-dioxin, a 2,4-D és a 2,4,5-T gyomirtók gyártásának mellékterméke) A benzol (és az aromás vegyületek) kémiai
tulajdonságai • A benzol katalitikus hidrogénezése ciklohexánhoz vezet: H2 (PtO2) • Brómmal (vas katalizátor jelenlétében) és salétromsavval (kénsav jelenlétében) elektrofil szubsztitúció játszódik le: H Br Br2 (Fe) H + HBr NO2 HONO2 (H2SO4) + H2O Fontosabb aromás vegyületek • Benzol:r é ge nakős z é n ká t r á nyl e pá r l á s á v a lny e r t é k,maf ől e ga b e n z i nf r a kc i ókr a kkol á s á va lá l l í t j á ke l ő.Er ős e nr á kke l t ő,ki s koncentrációban is leukémiát okozhat. Felhasználása s z é l e s kör ű:ol dós z e r ,v e gy i pa r ie l j á r á s oka l a pa ny a ga ,ok t á n s z á m növelésére alkalmas adalék. • Toluol, xilolok: krakkoláskor keletkeznek a benzol mellett. Ke v é s b év e s z é l y e s e k,ol dós z e r ké n t( , , a r omá shí gí t ó” )é s motorbenzin-a da l é kké n th a s z ná l j á kőke t . • 2,4,6-trinitro-toluol (TNT, trotil): nagy hatású robbanóanyag.
Használata viszonylag biztonságos, mert ütésre, rázásra nem robban. • Poliaromás szénhidrogének (PAH-ok): nem tökéletes égéskor keletkeznek (pl. dohányfüst, pirított kenyér, füstölt áruk) Rá kke l t ő,mut a gé nh a t á s úa ny a goki ge nki sme nnyi s é gbe ni s . Köszönöm a figyelmet!




