Please log in to read this in our online viewer!
Please log in to read this in our online viewer!
No comments yet. You can be the first!
Content extract
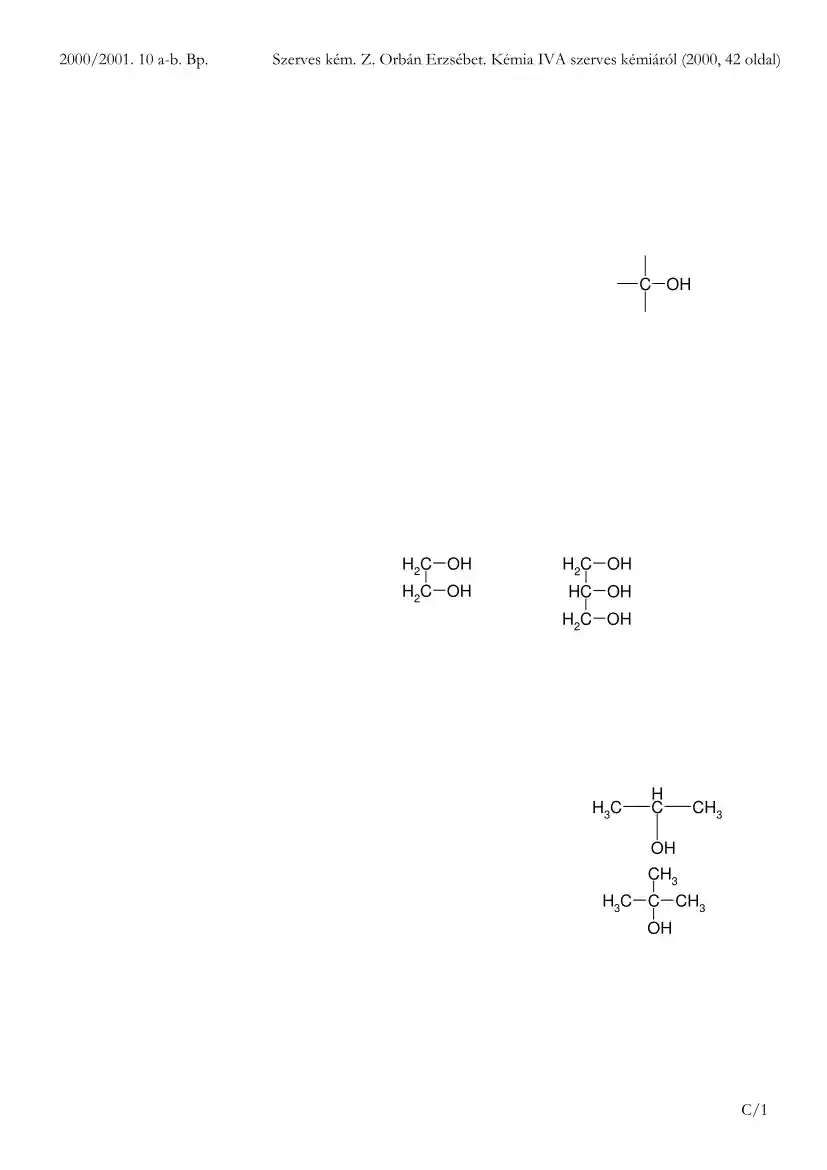
2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A szerves kémiáról A. B. C. Bevezetés A szénhidrogének Oxigéntartalmú szerves vegyületek I. Hidroxi-vegyületek: alkoholok és fenolok általában 1) Def.: Hidroxi-vegyületeknek nevezzük azokat az oxigéntartalmú vegyületeket, amelyek molekulái C OH hidroxilcsoportot (–OH) vagy -csoportokat tartalmaznak: a) Def.: Az alkoholok: olyan hidroxivegyületek, melyek molekuláiban nyílt láncú vagy gyűrűs, telített vagy telítetlen szénhidrogéncsoporthoz egy vagy több hidroxilcsoport kapcsolódik. b) Def.: A fenolok azoka a hidroxivegyületeket, melyek molekuláiban a hidroxilcsoport(ok) aromás gyűrűhöz kapcsolódik(nak). 2) Az alkoholok a) Csoportosításaik (i) Értékűség szerint lehet egyértékű kétértékű háromértékű v. több CH 3 CH 2 –OH H2C OH H2C OH H2C OH HC OH H2C OH etil-alkohol glikol glicerin etanol etán-1,2-diol propán-1,2,3-triol
(ii) Szénlánc felépítése szerint: telített, telítetlen, nyíltláncú, gyűrűs (iii) A hidroxilcsoport helyzete szerinti csoportosítás: rendűség 1. rendű: primer butan-1-ol 2. rendű: szekunder izopropil-alkohol propan-2-ol 3. rendű: tercier: izobutli-alkohol 2-metilpropan-2-ol (iv) A propan-1-ol homológ sora Többféle homológ sor is lehetséges. Az alkánokból: alkanol-ok C n H 2n+1 –OH CH 3 CH 2 CH 2 CH 2 OH H3C H C CH3 OH CH3 H3C C CH3 OH C/1 2000/2001. 10 a-b Bp b) c) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Elnevezések Az alkán neve után -ol végződés teszünk. A hidroxilcsoport helyzetét számmal jelöljük. Az alkoholok funkciós csoportjának elektronszerkezete (Kajtár: Vált. 4 elemre:271o) „Nagy hiba lenne, ha valaki egy alkohol általános képletét látva azt gondolná, hogy maga az alkohol olyasféle vegyület, mint egy „lúg”, pl. a nátrium-hidroxid, mert mind a kettőben
„hidroxi.” van R–OH Na–OH Na+ OH– jó rossz jó A két vegyület között óriási különbség van! Az alkoholban a hidroxilcsoport kovalens kötéssel kapcsolódik az alkilcsoport egyik szénatomjához. A két csoport egyetlen molekula két részlete; a csoportokat csak mi különítjük el gondolatban. A nátrium-hidroxid ezzel szemben ionos vegyület, amelynek igazából nincs molekulája, hanem a kristályrácsban független nátriumionok és hidroxidionok helyezkednek el egymás mellett. Az OH– ion külön, önmagában is létezik, a OH– csoport nem, az csak részlete egy alkohol molekulának. Sőt: d) ∆EN O–H = 1,4 ∆EN C–H = 0,4 Vagyis az O–H kötés polározott, inkább a H+ proton tud leszakadni, vagyis nagyon erős lúgokkal szemben (Na igen, NaOH már nem!) savként viselkedik. Az alkoholok fizikai tulajdonságai R–OH : a szénlánc és a OH– csoport együttesen befolyásol: C C C C OH apoláros poláros Mennél hosszabb az
apoláros rész, annál jobban az a meghatározó, viceversa. Ez mind az oldhatóságnál, mind az Op-Fp-nál megvan! A hidroxilcsoport oxigénjének van nemkötő elektronpárja, a hidrogén pedig egy nagy EN-ú atomhoz (oxigén) kapcsolódik, így minden feltétel megvan a hidrogénkötés, a hidrogén híd kialakulásához. Ez nagyon erősen befolyásolja a fizikai tulajdonságokat! Oldhatóság: Kis C atomszám esetén a hidroxilcsoport a befolyásoló: hidrogénkötés jöhet létre a víz és az alkohol molekulák között. Így a kis szénatomszámú alkoholok jól oldódnak vízben. A nagy szénatomszámúaknál azonban már az apoláros rész befolyásol, s így egyre kevésbé oldódnak vízben. C/2 2000/2001. 10 a-b Bp e) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Op–Fp Az Op–Fp-nél is erősen befolyásol a hidrogén kötés. A kis szénatomszámú alkanolok Fp-ja jóval nagyobb, mint a hozzá hasonló tömegű paraffinoké:
ugyanis un. asszociátumok alakulnak ki, s úgy viselkednek, mintha „nagyobbak” lennének a molekulák: ∆Fp Vegyület Fp Vegyület Fp 65 C2H6 –88 153 CH 3 –OH C 2 H 5 –OH 78 C3H8 –42 120 97 C 4 H 10 0 97 C 3 H 7 –OH 118 C 5 H 12 36 82 C 4 H 9 –OH 138 C 6 H 14 68 70 C 5 H 11 –OH Megfigyelhető, hogy mennél nagyobb az apoláris lánc, annál kevésbé befolyásol a hidroxilcsoport, ergo: kisebb az Fp-ok közti különbség. Természetesen a többértékű alkoholok több hidrogénkötést tudnak kialakítani, így ott még nagyobbak a különbségek: Vegyület Fp Vegyület Fp ∆Fp HO–CH 2 CH 2 –OH 198 C 4 H 10 0 198 glicerin 290 3-metilpentán 63 227 Az alkoholok kémiai tulajdonságai + reakciók (i) A savasságra visszavezethető reakció • Az alkoholok vízzel szemben azonban „semleges” vegyületnek mondhatóak, mert az alkohol-molekulák gyakorlatilag nem adnak át és nem is vesznek föl protont a víztől. • Még NaOH -dal sem reagálnak
Összefoglalva: az alkoholok nagyon gyenge savak, még a víznél is gyöngébbek. (Láttunk már ilyet: pl: acetilén) (ii) Reakció nátriummal • Az alkoholok nátriummal hidrogénfejlődés mellett nátriumsókká alakulnak át: ezek neve: nátrium-alkoholát. Pl: CH 3 CH 2 –OH + Na CH 3 CH 2 –O:– + Na+ + ½ H 2 Azonban ez nem egy igazi sav-bázis reakció: A lehasadó protont nem egy bázis köti meg a nemkötő elektronpárjával, hanem a nátrium átad neki egy elektront, s így a protont hidrogénné redukálja, miközben maga Na+-ná oxidálódik! Vagyis ez igazából: redoxi-reakció! A nátrium-alkoholátok ionos vegyületek ⇒ vízben oldódnak. vizes oldatuk lúgos kémhatású: ← R–O:– + H–OH R–OH + OH– (iii) Reakció erős savakkal: C/3 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A molekulában kötött oxigénatomnak mindig van nemkötő elektronpárja, ezért erős savakkal
szemben (HCl; H 2 SO 4 ) bázisként viselkedhet. Lássuk először, hogy viselkedik a víz: Éppígy viselkedik az alkohol is: protonálódik. Ebben a sav-bázis reakcióban ő a bázis 1 . Protonált állapotban az alkoholok (és az éterek) különleges reakcióban vehetnek részt: A fenti egyenlet szerint a fordított irányban az történik, hogy a kloridion egy protont hasít le egy szénhidrogéncsoporttal helyettesített oxóniumionról. Az is megtörténhet, hogy a kloridion egy szénhidrogén-kationt szakít le a pozitív oxigénatomról! Ezért tömény sósavval főzve az alkoholok alkil-kloriddá és vízzé alakíthatóak át. Így lehet alkoholokból alkil-halogenideket képezni. (iv) Oxidációjuk: lsd. aldehidek, ketonok (v) Éterképzés lsd. éterek (etanolból keletkezhet etén is!) (vi) Észterképzés lsd. karbonsavak C/4 2000/2001. 10 a-b Bp 3) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A fenolok a) A fenolok
funkciós csoportjának elektronszerkezete A fenolokban: Ar–OH : a hidroxilcsoport közvetlenül az aromás gyűrűhöz kapcsolódik. Így a fenolos hidroxilcsoport-ban az O–H kötés polárosabb, mint az alkoholos hidroxilcsoport-ban Ez nagyon jól megmagyarázza mind a fizikai, mind a kémiai tulajdonságait. b) A fenolok fizikai tulajd. Pl konkrétan a fenol Oldhatóság Vízben egy kicsit oldódik, de még mindig jobban, mint a neki megfelelő aromás vegyület. Az oldhatóság a hidroxilcsoportok számától függ Op-Fp: általában kristályos anyagok, a fenol Op-Fp je jóval magasabb, mint a neki megfelelő toluolé: a hidrogénkötés az ok. c) A fonolok kémiai tulajd. + reakciók (i) A savasságra visszavezethető reakció • Vízzel: OH + H2O O + H3O+ Sőt, a víznél erősebb savak: ez a reakció ezerszer gyakoribb, mint a víz öndisszociációja! • A következő reakció is ezt mutatja: Ar–OH + Na+ + OH– C 6 H 5 O:– + Na+ +H 2 O. fenol nátrium-hidroxid
nátrium-fenolát víz Vagyis vizes oldatban a nátrium-hidroxiddal sót képez! (Emlékszünk: ha a víz erősebb sav lenne, ez vizes oldatban nem történne meg, mert akkor víz hatására kiszorulna a sójából!) • Nátrium-hidrogénkarbonáttal szemben azonban már nem elég savas, vele reakciót nem ad! (ii) Oxidációjuk: lsd. később C/5 2000/2001. 10 a-b Bp II. Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Fontosabb alkoholok, fenolok 1) Etanol (etil-alkohol, borszesz) a) Általában Víztiszta, kellemes illatú folyadék. A kereskedelemben: „tiszta szesz”=96%-os etanol. A vízmentes, absz alkohol: 100%-os b) Szerkezet CH 3 CH 2 –OH Az alkoholok általános jellemzése után c) Tulajdonságok Az alkoholok általános jellemzése után szinte minden tulajdonság kitalálható: Vízzel korlátlanul elegyedik. Jól oldja a zsírokat, olajokat is Op: –114 °C, Fp: 78°C d) Reakciói: (i) Égés: C 2 H 5 –OH + 3O 2 2CO 2 + 3H
2 O ∆ r H=–1365 kJ/mol ⇒ üzemanyag! Kékes lánggal ég. (ii) A nátriummal adott reakcióját már ismerjük: redoxi reakció! 2C 2 H 5 –O-H +2Na 2C 2 H 5 –O– + 2Na+ + H 2 ↑ etilát-ion nátrium-etilát e) Előállítás (i) Természetes: szeszes erjedés: A cukortartalmú gyümölcsök levéből a levegőben lévő élesztőgombák enzimjei hatására alkohol keletkezik. A felszabaduló energiát az élesztőgombák az életfolyamataikhoz használják fel. enzim C 6 H 12 O 6 2C 2 H 5 –OH + 2 CO 2 Erjesztéssel legfeljebb 15%-os alkohol-oldat állítható elő: töményebben már az élesztőgombák elpusztulnak. Lepárlással: 96%-os elegyig lehet eljutni. Tovább nem, mert itt ugyanolyan a gőzfázis összetétele, mint a folyadékfázisé. „Azeotrop” elegy. Alkoholos levek lepárlásakor (pálinkafőzés) az esetleg kis mennyiségben jelen lévő metil-alkohol, alacsonyabb forráspontja miatt, az első cseppekben távozik („rézeleje”), ezrét
ezt meg kell semmisíteni. A régi telepítésű, ún. direkttermő szőlőből (pl: nova) készült borok jelentős mennyiségű faszeszt tartalmazhattak. Általános nézet, hogy az első, valóban „mesterséges” alkoholos ital a sör volt, mert a földművelésre való áttéréskor leginkább gabonát, árpát termesztettek és tároltak. Ez tároláskor kicsírázhatott, s megerjedhetett. A sör mellett szólnak azok a legrégebbi írásos emlékek is, amelyeket Egyiptomban és Mezopotámiában találtak. C/6 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Alkohol tart. ital Alk. tart t% alapanyag sör 3-8 árpa, komló bor 5-14 szőlő likőrök 20-40 alkohol, cukor, aroma égetett szeszek 40-80 konyak bor whisky rozs vodka burgonya, gabona gyümölcspálinka barack, körte, cseresznye stb. rum cukornád Tovább, töményebb alkoholig vízelvonó szert felhasználva lehet jutni. (ii) Ipari: • Földgázból
kiinduló Eténből: Az etén általában krakkgázként áll elő! Lsd: B/V/4/b/iii Acetilénből: az acetilén a metán hőbontásából áll elő 2) • Kőszénből: Kőszénből szintézisgázt készítenek, abból metanolt, majd a metanolból etanolt. (metanolkészítés lsd ott) CH 3 OH + CO + 2H 2 CH 3 CH 2 OH + H 2 O f) Felhasználás Főleg: Étkezés hatásai, szonda Vegyipar: oldószer, extrahálószer. Üzemanyag: nem környezetszennyező üzemanyag benzin helyett! Denaturálás: A nem étkezési célra használt alkoholt (oldószer, borszeszégő) emberi fogyasztásra alkalmatlanná teszik: kis mennyiségű piridin hozzákeverésével „denaturálják.” Metanol a) Általában + szerkezet: lsd. etanol b) Tulajdonságok: lsd. etanol c) Előállítás E század elejéig kizárólag a fa száraz desztillációjából állították elő. Ma már: Túlnyomó részben szintézisgázból készül: katalizator d) CH 3 OH CO + 2H 2 Felhasználás Kitűnő oldószer; jó
energiaforrás, üzemanyag: jó oktánszámú, kipufogógázai tiszták; egyéb vegyület kiindulási alapanyaga. C/7 2000/2001. 10 a-b Bp e) 3) Méreg: halálos adagja: testsúly-kilogrammonként kb. 30 mg Már kevés is fejfájás, hidegrázást okoz. Több: vakság, halál Glikol (etán-1,2-diol) a) A nevét a glicerinnel együtt a görög „glüküsz” = édes szóból kapta: édes ízűek. H2C OH b) Szerkezete c) 4) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) H2C OH Fizikai tulajdonságok A sok és erős hidrogénkötés miatt: jól oldódik vízben Op–Fp: magas nagy viszkozitás d) Felhasználása: jó fagyálló anyag: pl. 60 térfogat-százalékos vizes elegye csak –60°C-on fagy meg: autókba való fagyálló H2C OH Glicerin (propán-1,23-triol) a) Szerkezete HC OH b) c) H C OH 2 Fizikai tulajdonságok A sok és erős hidrogénkötés miatt: jól oldódik vízben Op–Fp: magas nagy viszkozitás higroszkópos
Felhasználása: • Az erős nedvszívó hatása miatt: A kozmetika iparban: hidratáló krémek készítéséhez használják: megakadályozza a bőr kiszáradását azáltal, hogy megköti a levegő nedvességtartalmát. (A magas glicerintartalmú krémek viszont éppen szárítják a bőrt, mert abból is kivonják a vizet.) A bélyegzőpárna-festéket is ebben oldják: megakadályozza a párna kiszáradását • A nitroglicerin (lsd. később): ütésre, melegítésre könnyen robban Porózus anyaggal (kovaföld, fűrészpor) felitatva biztonságos: dinamit. A robbanást a bomláskor történő nagy térfogat-növekedés idézi elő. A szerves robbanószereknél az éghető anyagokat és az égéshez szükséges oxigént is magába a molekulába építették össze, ami a keverékeknél közvetlenebb érintkezést és nagyobb égési sebességet biztosított. A nitrátok ilyen szempontból alkalmas vegyületek! (A nitroglicerin igazából nem nitrát, hanem észter!) Nobel
1867-ben fedezi fel a dinamitot (dünamisz=erő (gr)) Előtte sok baleset: Először egy robbanáskor az egyik testvére meghal, a másik megsérül. ⇒ A svéd hatóságok megtiltották hogy lakott terület mellett dolgozzanak ⇒ hajón van az üzem. Később: A New York-i Greenwich Streeten, a Hotel Wyoming portása egy vendég ládáját – mert vörösbarna gőzök szálltak fel C/8 2000/2001. 10 a-b Bp 5) 6) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) belőle, – kivitte a szálloda elé. Pillanatokra rá óriási kráter tátongott a helyén • A nitroglicerin gyors és erős értágító hatása miatt jó szívgyógyszer is (Nitromint) d) A glicerin az állati zsírok és a növényi olajok alkotórésze: lsd. később Koleszterin A koleszterin sokgyűrűs, HO kristályos vegyület, alkohol. A gerincesek szöveteiben található Először az epekőből különítették el. Van olyan epekő, amely majdnem tiszta kristályos
koleszterin. Innen a neve: „kholé” (görög) = epe, „sztereosz” = kemény Az élő szervezetben 6 izoprén-egységből álló molekulából (szkvalén) képződik, több lépésen át. Az ábrából látható, hogy ő is szteránvázas vegyület! Mentol: az egyik legismertebb terpénalkohol. Kristályos anyag: op: 43°C Hűvös, üdítő ízéről mindenki ismeri. A gyűrűs ciklohexán hidroxiszármazéka: a gyűrűhöz még egy metil és egy izopropil csoport kapcsolódik. OH 7) OH A második képleten jól látszódik a két izoprén-rész ⇒ terpénalkohol Fenol (karbolsav) a) Általában: Színtelen, kristályos anyag: levegőn állva pirosra, majd barnásvörösre színeződik Mérgező hatású: a mikroorganizmusokat elpusztítja⇒régen fertőtlenítésre használták. Bőrre kerülve veszélyes, hosszantartó égési sérüléseket okoz. b) Szerkezet: láttuk c) Fiz. tul: láttuk d) Kém. tul: láttuk e) Felhasználás: Vegyipari alapanyag: gyógyszerek (fenol
szalicilsav aszpirin), növényvédő-szerek, festékek, műanyagok. A kátrány a fenoltartalma miatt alkalmas fakonzerválásra. A húsok, kolbászok füstölésekor is a fenol az egyik konzerváló anyag. C/9 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) III. Éterek 1) Definíciójuk és elnevezésük Def.: Az éterek azok az oxigéntartalmú szerves vegyületek, melyek molekuláiban az oxigén 1-1 szénatomhoz kapcsolódik. Elnevezésük: „R 1 – R 2 – éter”. A két szénhidrogéncsoportot ábécé sorrendben írjuk fel. Pl.: C 2 H 5 –O– C 2 H 5 H 3 C–O– CH 3 CH 2 H 3 CH 2 C–O– CH 3 CH 2 dietil-éter etil-metil-éter 2) A funkciós-csoport szerkezete (Vált 4: 287.o) A molekula egy csak kismértékben dipólusos. Ugyanis nem túl nagy a ∆EN és ráadásul majdnem „bot” alakú a molekula, úgyhogy az eredő-vektor nem túl nagy! A hidrogén kötés két feltétele nincs meg: a hidrogén a
C-hez kapcsolódik. De ott van az O, ami nagy EN-ú és ∃ nemkötő elektronpárja, vagyis lehet akceptor. ⇒ más, megfelelő molekulákkal képes hidrogénkötést kialakítani 3) 4) Fizikai tulajdonságok a) Op-Fp Alig tér el a neki megfelelő szénhidrogéntől: (éter-csoport ↔metilén csoport), ui.: nagyon kis mértékben dipólusos Hidrogénkötésre meg végképp alkalmatlan. Tehát alapvetően diszperziós erők tartják össze, és egy kis dipólus-dipólus vonzás. pl.: b) Oldhatóság Az éter molekulák egymás közt nem, de mással alkothatnak hidrogénkötést. Így pl a vízzel Ez azonban gyengébb, mint a víz-víz közti H. kötés ⇒ csak kis mértékben. Valóban: pl: 1 cm3 éter 10 cm3 vízben Kémiai tulajdonságok a) Előállítás: konkrétan az éter: Vált 4. : 816 o + Kajt: IIo 113o Az etilalkohol közönséges hőmérsékleten: tömény kénsavval reagálva etilhidrogén-szulfáttá alakul át. Ez alakul tovább hőmérséklettől függően: Így
csak szimmetrikus éter állítható elő. Nem szimmetrikus: R–Cl + Na+ –:O–R’ R–O–R’ + NaCl alkil-halogenid + nárium-alkoholát C/10 2000/2001. 10 a-b Bp b) 5) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Reakció erős savakkal: Kajt.: IIo 107o + Vált 4: 288-289 Az alkoholokhoz hasonlóan az éterkötést létrehozó oxigén szintén megköthet protont. ⇒ Erős savval főzve: alkilkloriddá és alkohollá alakítható. (A képződött alkohol még tovább alakul alkil-kloriddá!) dietil-éter („éter”) a) Általában: Köznapi használatban az „éter” a dietil-éter. Színtelen, jellemző, bódító szagú, könnyen párolgó, alacsony Fp-ú folyadék. Rendkívül tűzveszélyes, levegővel robbanóelegyet képez! b) Szerkezet: láttuk c) Fiz. tul: láttuk d) Kémiai tul.+ reakciók: Égése: (C 2 H 5 )O + 6O2 = 4CO 2 +5H 2 O Képződése: láttuk Reakciója sósavval: láttuk e) Felhasználás: Régen altatásra
használták, ma már csak állatkísérleteknél alkalmazzák. C/11 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) IV. Az oxovegyületek 1) Definíció, és csoportosítás Az oxovegyületek azok az oxigéntartalmú szerves vegyületek, melyek molekuláiban az oxigénatom mondkét kötő vegyértékelektronjával ugyanazon szénatomhoz kapcsolódik. 2) 3) Az oxocsoport elektronszerkezete Az oxigén nagyobb elektronvonzó képessége a karbonilcsoportban még jobban érvényesül, mint az eddig megismert csoportoknál, hiszen a π-kötés könnyebben polarizálható, mint a σ-kötés. Ennek következtében az oxovegyületek reakcióképesebbek, mint az alkoholok vagy az éterek. Aldehidek a) Definíciójuk és elnevezésük Az aldehidek Olyan oxovegyületek, melyek molekulájában az oxocsoport elsőrendű – láncvégi – szénatomhoz kapcsolódik, tehát formil-, vagy más néven aldehidcsoportot tartalmaz. O
Általános képletük: C n H 2n+1 – CHO v. R – CHO A funkciós csoportot a molekulában mindig külön R C tüntetjük fel, de az elnevezéskor a molekula szénatomszámába H beleszámít! Elnevezés: a megfelelő szénatomszámú alkán nevéből „–al” végződéssel: pl: C 2 H 5 –CHO H–CHO CH 3 –CHO metanal etanal propanal formaldehid acetaldehid b) c) A funkciós-csoport szerkezete: láttuk Fizikai tulajdonságok (i) Op-Fp A karbonilcsoport erős polárossága miatt – a ketonokkal együtt – a megfelelő éternél nagyobb az Fp, de a megfelelő alkoholnál kisebb: hiszen a hidrogénkötés kialakulásának nincs meg a feltétele. C/12 2000/2001. 10 a-b Bp d) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (ii) Oldhatóság Hidrogénkötést képes kialakítani a vízzel, ez elősegíti az oldhatóságát. Ahogy azt már az alkoholoknál láttuk, az oldhatóság ugyanolyan oknál fogva kezdetben jó, majd a szénatomszám
növekedésével csökken. Kémiai tulajdonságok Reakciókézsége – ahogy azt a karbonilcsoport szerkezetének vizsgálatakor már láttuk – nagyobb, mint az alkoholoké és étereké. (i) Előállítása: alkohol oxidációjával, dehidrogénezéssel. Az aldehideket elsőrendű alkoholokból lehet előállítani oxidációval, jelen esetben hidrogénelvonással. Ezt a folyamatot dehidrogénezésnek nevezzük. Reakció leírása: Megfigyelés: Reakcióegyenlet. A dehidrogénezés az alkohol oxidációját jelenti: -2 +2 0 +2 H 3 C- O - H + Cu O H - C HO + Cu + H 2 O Ez a reakció az alapja az aldehid névnek: dehidrogénezett alkohol, latinul: alcohol dehiyd rogenatus. (ii) Redukciójuk: Kajtár II. 111o Az aldehidek túlságosan könnyen redukálódnak, molekulájuk hidrogénatomok felvételével elsőrendű alkohollá alakulhat vissza. Ekkor a szénatom oxidációs száma 0-ról –2-re csökken, a felvett hidrogénatomé 0–ról +1-re nő. A redukciót többféle
módon is meg lehet valósítani: például hidrogénátvivő katalizátor (palládium, platina) jelenlétében hidrogéngázzal. +2H H–CHO CH 3 –OH aldehid elsőrendű alkohol C/13 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (iii) Oxidációja: Két fontos reakció: az ezüsttükör-próba v. Tollenspróba, illetve a Fehling-reakció Az ezüsttükör-próba: A leírás: Megfigyelés: A reakció: Figyeljük meg, hogy a reakcióban a szén oxidációs száma 0-ról +2re növekedett, tehát a karbonil csoport szénatomja oxidálódott, míg az ezüst ion redukálódott. Miért kell az ammónia oldat? Miért nem öntöttük hozzá közvetlenül az AgNO 3 - oldatot? Mert a reakció valójában egyensúlyi reakció, ahol sav képződik, és az ezüstnitrát oldat savas, s így visszafelé tolná el a reakciót. Miért pont ammónium-hidroxid-ot használunk? Mert az ezüst a lúgos közegben Ag 2 O-dá alakul,
amit az ammónia old fel ezüst komplex ionként. Ez a reakció az aldehidek kimutatására alkalmas, tehát minőségi analízisben is felhasználható. A reakciót használják fel a tükrök és a karácsonyfadíszek készítésénél! A Fehling-próba: szintén aldehidek kimutatására szolgál. A reakciót tanuljuk meg: A leírás: Megfigyelés: A reakció: Fehling I: rézszulfát oldat Fehling II.: NaOH + a borkősav Na és K sója: Natartarát. Szintén azért kell, hogy a keletkezett sötétkék Cu(OH) 2 csapadékot a borkősav sója oldatba vigye: Cu2+ és 2OH– alakban. (A közbenső sárga szín: CuOH, vagyis réz-I-hidroxid csapadék! 2 ilyenből lesz vízkilépéssel Cu 2 O A reakció az ezüsttükör próbához hasonlóan az aldehidre nézve oxidációs folyamat, melyben karbonsav keletkezik. C/14 2000/2001. 10 a-b Bp e) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Fontosabb aldehidek (i) metanal (formaldehid) Színtelen,
szúrós szagú gáz. Fp= –21°C Vízben jól oldódik Vizes oldata: Az oxovegyületek vizes oldatban részben vagy teljesen hidrátalakban, azaz mint geminális diolok fordulnak elő. Azonban ezek csakis vizes oldatban stabilak: Tehát reakciója a vízzel: Metán-diol keletkezik, ami azonban csak vizes oldatban stabilis. A keletkező formaldehid-hidrát állás közben – vízkihasadással – lassan fehér színű csapadékká polimerizálódik, melyben a monomerek száma 8–100: Sejtméreg, baktériumölő hatású, ezért fertőtlenítésre használják. Felhasználása: A gyakorlatban a 40%-os oldatát, a formalint használják: fertőtlenítésre. A húsok tartósításakor a füstöléskor a fenol mellett a másik konzerváló anyag! Az iparban műanyaggyártásra használják. (ii) etanal (acetaldehid) Jellegzetes szagú, alacsony Fp-ú (20°C) folyadék. Az acetilénből gyártják. Láttuk: (B/VII/2/d/ii) katalizátor (H 2 C=CH–OH) CH 3 –CHO HC≡CH+H 2 O
(vinil-alkohol) acetaldehid Az etanolból történő laborbeli előállítását láttuk. Rendkívül fontos alapanyaga a vegyiparnak: festékek, gyógyszerek, O műanyagok kiindulási alapanyaga. H2C C C (iii) 2-propenal (akrilaldehid) H A szagát mindenki ismeri: az odaégett zsír szagának szaganyaga.H A nevét is innen kapta: „acris” = szúrós (lat.) Valóban: a zsírok – ahogy azt látni fogjuk – glicerinszármazékok, s ha megfigyeljük az akril-aldehidet, észrevehetjük, hogy olyan, mintha a glicerinből kiszakadt volna két vízmolekula. (iv) benzaldehid: színtelen, keserűmandula szagú folyadék. Vízben nem oldódik Belőle állítják elő a fahéjaldehidet, (3-fenil-propénal) amit szappan-illatosításra, aromák, illatszerek előállítására használnak. H O C H C C O C/15 2000/2001. 10 a-b Bp 4) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Ketonok a) Definíció + elnevezés Def.: A ketonok azok az
oxovegyületek, melyekben a az oxocsoport láncközi szénatomhoz kapcsolódik. Funkciós csoportja a karbonil-, v ketocsoport. Általános jelölésük: R–CO–R’ Elnevezés: „szénhidrogén –№ –on” C 2 H 5 –CO– CH 3 C 2 H 5 –CO– C 2 H 5 CH 3 –CO– CH 3 propanon (aceton) butan-2-on pentan-3-on b) A funkciós csoport elektronszerkezete: láttuk c) Fizikai tulajdonságok (i) Op-Fp: A karbonilcsoport már megismert tulajdonsága miatt az éterek és az alkoholok között foglal helyet. De miért nagyobb az aldehideknél? Hasonlítsunk össze egy ketont és egy aldehidet: O CH3 C CH2 CH3 H C CH2 CH2 CH3 O d) Észrevehető, hogy míg a ketonban az oxocsoport olyan szénatomhoz kapcsolódik, melynek mindkét irányban van C atom szomszédja, addig az aldehidben a karbonilcsoportnak csak egy irányban van C szomszédja. Így a ketonban az oxocsoport jobban el tudja vonzani a karbonilcsoport szénatomjától a két kötő elektronpárt, hiszen a karbonilcsoport
jobbról-balról még tud magához vonzani elektront. Tehát nagyobb lesz a ketonban az oxigén parciális negatív töltése, mint az aldehidben, vagyis erősebb lesz a dipólus-dipólus kölcsönhatás. (ii) Oldhatóság: lsd. aldehidek: hidrogénkötés stb Kémiai tulajdonságok A ketonok kevésbé reakcióképesek, mint az aldehidek. (i) Előállításuk: a ketonok másodrendű alkoholokból, hidrogénelvonással, vagyis oxidációval hozhatóak létre. O H H3C C CH3 + CuO H O H3C C CH3 +H 2 O + Cu C/16 2000/2001. 10 a-b Bp e) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (ii) Nem redukáló tulajdonságúak, mint az aldehidek. A két aldehidet kimutató próbát ők nem adják. Csak nagyon erős oxidálószerekkel lehet oxidálni őket karbonsavvá. Ilyenkor felszakadnak, és karbonsavak keletkeznek. Ha egy R’–CO–R nem szimmetrikus ketont oxidálok így, akkor nem mindegy, hogy hol szakad el a kötés: R’–C v. C–R
között, mert más lesz a keletkező karbonsav! (iii) Redukciójuk: hidrogénatom felvételével másodrendű alkoholokká redukálhatóak: Fontosabb ketonok (i) Aceton (dimetil-keton, propan-2-on) A legegyszerűbb és legfontosabb keton. Kellemes illatú, alacsony Fp-ú (56°C), jellegzetes szagú folyadék. Vízzel és szerves folyadékokkal egyaránt korlátlanul elegyedik. Kitűnő oldószer! Festékek, lakkok oldásához használják. Dukkózás: Az acetonban oldott festéket sűrített levegővel rápermetezik a befestendő felületre, az aceton ezután gyorsan elpárolog, és a festék ott marad. Iparban az izopropil-alkoholból állítják elő. (ii) kámfor és H3C karvon (kömény és kaporban) lsd limonén! CH3 O H3C O 5) A tercier alkoholokból már nem dehidrogénezhetőek. C/17 2000/2001. 10 a-b Bp V. Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Karbonsavak 1) Definíciójuk és elnevezésük, csoportosításuk a) Def.
Karbonsavaknak hívjuk azokat a szerves vegyületeket, melyek molekuláiban a karboxilcsoport a jellemző funkciós csoport. A karboxilcsoport az azonos szénatomhoz kapcsolódó oxo- és hidroxilcsoportból felépülő összetett funkciós csoport. Egy karbonsavmolekulában csoportokat: különbözőképpen szénhidrogéncsoport – acilcsoport – karboxilcsoport hidroxilcsoport b) jelölhetünk ki savmaradék – hidrogénatom Elnevezésük: A szabályos elnevezésük az alapszénhidrogén (beleértve a karboxilcsoport szénatomját is) nevével és a sav szóval történik. Pl: C 2 H 5 –COOH H–COOH CH 3 –COOH metánsav etánsav propánsav hangyasav ecetsav propionsav A karbonsavak többsége már régóta ismert, főleg növényekből és állatokból izolálták őket. A triviális neveik általában annak a növénynek, állítnak stb. a nevéből adódnak, amelyekből kinyerték őket: hangyasav, almasav, citromsav stb. A többit majd a szisztematikus
tárgyalásnál nevezzük el. C/18 2000/2001. 10 a-b Bp c) 2) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Csoportosítás: • szénlánc szerint: telített, telítetlen, aromás, vagy egyéb funkciós csoportot tartalmazó szénlánc • a karboxilcsoportok száma szerint: egy-, kettő-, háromértékű karbonsav (mono-, di-, tri- előtag) A funkciós-csoport szerkezete (Pfeifer: 116.o) + Vált 4 el: 195-196-; A karboxilcsoport összetett funkciós csoport. Tulajdonságai eltérnek az őt alkotó két csoport tulajdonságaitól. A speciális szerkezet miatt az oxigénatom és a hidrogénatom közötti kötés erősen polarizálódik, következésképpen a hidrogénion már víz hatására is lehasad, tehát a karboxilcsoportot tartalmazó vegyületek vizes oldatai savas kémhatásúak. A kettős kötés π elektonpárját az oxocsoport-rész erősen maga felé húzza, emiatt a szénatom kevésbé engedi át az a másik oxigénatommal
létesített egyszeres kovalens kötés elektronpárját az oxigénatomnak, ami így kénytelen a hidrogénnel létrehozott σ kötést a szokottnál jobban polározni. A proton leszakadása után a karboxilátionban mindkét C–O kötés távolsága egyforma, ez azt jelenti, hogy a negatív töltés egyenletesen oszlik el a delokalizáló π-kötéssel együtt az egy síkba kifeszülő három atom alatt és fölött. C/19 2000/2001. 10 a-b Bp 3) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Fizikai tulajdonságok a) Op-Fp A karbonsav molekulák egymás között hidrogénkötést képesek kialakítani. Ez erősebb mint az alkoholok között, mert az O–H kötés erősebben polározott. A két karboxilcsoport között két erős hidrogénkötéssel összetartott gyűrű jön létre, így a részecskék dimerek alakjában vannak jelen. Ezért a forráspontjuk közelítően a kétszeres molekulatömegű szénhidrogénekével azonos, és az
alkoholokénál magasabb. b) Oldhatóság Már a szokott elvet lehet vizsgálni. Képes hidrogénkötést kialakítani a vízzel, ezért a kis apoláris résszel rendelkező savak jól oldódnak. Azonban mennél nagyobb az apoláris rész, annál kevésbé oldódnak. C/20 2000/2001. 10 a-b Bp 4) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Kémiai tulajdonság a) Előállításuk Többféleképpen lehet, és az iparban valóban többféleképpen állítanak is elő karbonsavakat. Itt az oxidációval történő előállítást vizsgáljuk: Aldehidből: Láttuk az aldehidek kimutatására alkalmas Tollens és Fehling próbát, amellyel egyben savat állítottunk elő. Felírtuk az aceton erélyes oxidációját cc. salétromsavval, amely során hangyasav és ecetsav keletkezett. b) Redukciójuk (Vált. 4 elemre: 346o) A karbonsavak – a széndioxidtól eltekintve – a szén legstabilabb oxidált származékai. Csak nagy
energia-befektetés árán, igen erélyes redukálószerrel lehet őket ebből a „mély energiaszintből” kimozdítani. De ilyen erélyes módszerrel viszont az átmenetileg keletkező aldehid sokkal gyorsabban és könnyebben redukálódik tovább, mint egy újabb karbonsav molekula. Így biztos, hogy a végállomás az alkohol redukció R–COOH erélyes R–CH 2 OH Az energiamodellen látható, hogy a meglökött golyó nem áll meg az aldehidnél, hanem legurul az alkohol szintjére. C/21 2000/2001. 10 a-b Bp c) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Savasságukra visszavezethető reakciók: (i) Vízzel A karbonsavak molekulái a vízmolekuláknak protont adhatnak át, ezért vizes oldatuk kémhatása savas. R–COO– + H 3 O+ R–COOH + H 2 O karboxilátion (ii) NaOH-dal: Vízben oldva az ecetsavnak csak kb. a 0,4 %-a disszociál, de ez ilyen erős lúg jelenlétében eltolódik! CH 3 COOH (l) + Na+
(l) +OH– (l) = CH 3 COO– (l) + Na+ (l) + H 2 O (iii) NaHCO 3 -tal. A NaHCO 3 . vizes oldatában hidrogén-karbonát-ionok vannak, (HCO 3 –) amelyek a savas természetű molekuláktól protont vesznek át, és így szénsavvá (H 2 CO 3 ) alakulnak át: A szénsav azonban bomlékony vegyület: H 2 CO 3 ⇔ H 2 O + CO 2 . A keletkező széndioxid pedig kipezseg az oldatból. Összegzés: Az ecetsav erősebb sav, mint a szénsav, ezért ezektől a hidrogén-karbonát ion átveszi a protont. (iv) Mg, Cu A hidrogénnél nagyobb redukálóképességű (kisebb standardpotenciálú) fémek az oxóniumionokat hidrogénfejlődés közben redukálják: 2 R–COO– + 2H 3 O+ + Mg = 2 R–COO–+Mg2+ + H 2 + 2H 2 O Rézzel azonban nem reagál! (v) pH táblázat: A savasságuk összehasonlítva más vegyületekkel: C/22 2000/2001. 10 a-b Bp d) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A savasság függése a molekulaszerkezettől. Híg oldatban:
K sav =[H 2 O]⋅(sav egyensúlyi állandója) Egy sav annál erősebb, mennél könnyebben le tudja adni a proton. (Igazából annál erősebb egy sav, mennél stabilabb a belőle proton lehasadásával keletkező anion.) Ha megfigyeljük a hangyasavat és a vajsavat, akkor a következőt állapíthatjuk meg: H H H O O H C C C C H C O H H H H O H A hangyasav hidroxilcsoportjának oxigénje egy olyan szénatomhoz kapcsolódik, amelyhez csak egy H és egy Oxocsoport kapcsolódik, míg a vajsavnál a Hidrogén helyett egy propilcsoport található. Ez utóbbinál tehát a szénláncon egy kicsit az karbonilcsoport szénatomja felé tud tolódni az elektronfelhő, így a hidroxilcsoport Oxigénje egy kevésbé elektronhiányos szénatomhoz kapcsolódik, mint a hangyasavnál. Így kevésbé polarizálódik az O–H kötés, vagyis nehezebben szakad le, mint a hangyasavnál. Kitalálható, hogy akkor hogyan lehet növelni egy karbonsav erősségét. A klórozott ecetsavnál
nézhetjük a disszociáció mértékét: H H C C H H O Cl O H 0,4% O O H klór-ecetsav 4% Cl Cl O Cl H C C C C H Cl O H diklór-ecetsav 20% O C C Cl O H triklór-ecetsav 40% A legerősebb halogén karbonsav a trifluor-ecetsav. Ennek 1 mólos vizes oldatában a molekulák gyakorlatilag 100%-ban disszociálva vannak, akárcsak a sósavban. Kitalálható, hogy egyéb szubsztituensekkel is erősíthetőek a karbonsavak. e) Észterképződés: később. C/23 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) VI. Fontosabb karbonsavak I: Alkánsavak (telített alkánokból levezethető savak): zsírsavak 1) Kis szénatomszámúak a) Hangyasav (Metánsav) (Lsd.: Pfeiffer: 116-117, 120 o (i) Általában O Nagyon csípős szagú és ízű, erősen maró hatású folyadék. A legegyszerűbb monokarbonsav A H C H vöröshangyák csípős váladékából vonták ki először, innen a neve. A hangyacsípéskor ez a sav
ingerli a szöveteket De más állatok, és növények (pl.: csalán) nedvében is megtalálható (ii) Fizikai tulajdonságok Fp: 101°C : a molekulatömeghez képest magas: hidrogénkötés! Oldhatóság: vízzel minden arányban elegyedik (iii) Kémiai tulajdonságai • Az egyszerű monokarbonsavak közül a legerősebb. • A hidrogénnél nagyobb redukálóképességű fémeket (Mg, Ca stb) hidrogénfejlődés közben oldja: 2 H–COOH + Mg = 2 H–COO– + Mg2+ + H2 Sói a formiátok: „magnézium-formiát” • Oxidációja: Az egyedüli karbonsav, mely egyben aldehid is, ezért az aldehidekhez hasonlóan redukáló tulajdonságú, oxidálható: Ezüsttükörpróba: O + – 2Ag + 2OH + 2Ag + CO 2 + 2H 2 O H C O H De a brómos vizet is elszínteleníti, vagyis a vízben oldott brómot bromid-ionná redukálja, miközben maga CO 2 -dá oxidálódik: H–COOH + Br 2 = CO 2 + 2Br– + 2H+ • Bomlása és előállítása Tömény kénsavval hevítve elbomlik: így
állítanak elő laborban szénmonoxidot: .H SO H–COOH cc CO + H 2 O Ha azonban tömény NaOH oldatba nagy nyomáson CO-ot sajtolnak, akkor nátrium-formiát keletkezik. Ebből a sóból aztán erős savval lehet felszabadítani a hangyasavat: atm;100 C NaOH + CO 10 HCOONa H SO HCOONa HCOOH (iv) Felhasználás Nagyobb mennyiségben a textil- és a bőriparban alkalmazzák. (Pl: bőrcserzésre) 2 4 o 2 4 C/24 2000/2001. 10 a-b Bp b) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Ecetsav (Etánsav) (i) Általában Szúrós szagú, színtelen folyadék. Természetes úton a borok levegővel történő érintkezése során képződik. A vízmentes ecetsav 17°C alatt kristályosodás következtében megszilárdul, ezért a tömény ecetsavat szokás jégecetnek is nevezni. (ii) Szerkezete: már láttuk. (iii) Fizikai tulajdonság Fp: 118°C : hidrogénkötés! Oldhatóság: vízzel minden
arányban elegyedik (iv) Kémiai tulajdonság • Savassága: A vízben való oldódása protolitikus, sav-bázis reakció: CH 3 –COO– + H 3 O+ CH 3 –COOH +H 2 O Az 1 mol/dm3 töménységű oldatban a molekuláknak csak a töredéke (kb. 0,4 %-a) adja le a protonját Így eléggé gyönge savnak számít: 0,004 mol dm 3 ⋅ 0,004 0,996 mol mol dm 3 ≈1,6⋅10–5 dm 3 • A hidrogénnél nagyobb redukálóképességű fémeket (Mg, Ca stb) hidrogénfejlődés közben oldja: 2 CH 3 –COOH + Mg = 2 CH 3 –COO– + Mg2+ + H 2 Sói az acetátok: „magnézium-acetát” • Előállítása: Étkezési célra: Az alkoholos oldatot olyan bükkfaforgácson csurgatják át, amelyre előzőleg ecetsvbaktériumokat telepítettek, és felfelé levegőt áramoltatnak. Először acetaldehid, majd abból ecetsav keletkezik: .: − 2 H ox.: +O CH 3 -CH 2 –OH ox CH 3 –CHO CH 3 – COOH Ilyen biológiai úton csak híg ecetsav állítható elő, mert az
ún. ecetgombák mind a tömény alkohol, mind a tömény ecetsav hatására elpusztulnak. Itt jegyzendő meg: alkohol fogyasztáskor is ez a folyamat játszódik le, majd a keletkező ecetsav a normális anyagcserében továbbalakul. A metil-alkohol viszont formaldehiddé alakul, amit azonban a szervezet nem tud tovább oxidálni: így a felhalmozódó sejtméreg súlyos károsodásokat okoz. Nagyipari előállítás. Acetilénből vízaddícióval, ahogy azt már láttuk. C/25 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (v) Felhasználás • A szervezetben az élő sejt anyagcseréjében van nagy szerepe: A táplálékkal felvett anyagokat (fehérjéket, szénhidrátokat, zsírokat) a sejt főként acetilcsoportokká alakítja. Az élő sejtben az ecetsav nem szabad állapotban, hanem egy bonyolult molekulához, a koenzim-A -hoz kapcsolódik:: ez az acetilkoenzim-A. O H3C C koenzim-A Az ecetsavat a sejt vagy
energiatermelésre használja fel, vagy a saját molekuláit építi fel belőle. c) 1975-ben az angol Cornforth kapott Nobel-díjat azért, mert felderítette, hogyan készít az élő sejt ecetsavrészekből koleszterin-molekulát. • Ételízesítés • Az iparban főleg gyógyszerek, festékek, műanyagok előállítására használják fel. Egyéb kis-szénatomszámú monokarbonsavak (i) propionsav: CH 3 –CH 2 –COOH A nátriumsóját élelmiszerekben és takarmányokban a penészedés meggátlására használják. (ii) A vajsav és a valeriánsav: C 3 H 7 –COOH és C 4 H 9 –COOH A vajsav glicerinhez kötve fordul elő a vajban, s annak avasodásakor szabadul fel. Ő és a valeriánsav minden egyes emberben más-más arányú keveréke adja azt a jellegzetes izzadságszagot, amelyet a kutya képes megkülönböztetni. C/26 2000/2001. 10 a-b Bp 2) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Nagy szénatomszámú
monokarbonsavak (Z.Orbán: 93o) a) Def. + Néhány fontosabb nagy szénatomszámú monokarbonsav Nagyszénatomszámú karbonsavaknak elnevezése önkényes, kb. a C 10 -C 20 -ig terjedő karbonsavakat. Pl.: COOH C 15 H 31 –COOH hexadekánsav = palmitinsav sói: palmitátok COOH C 17 H 35 –COOH oktadekánsav = sztearinsav sói: sztearátok 10 18 9 COOH C 17 H 33 –COOH cisz - 9 - oktadecénsav = olajsav sói: oleátok 12 13 18 10 9 COOH C 17 H 31 –COOH 9-cisz, 12-cisz-oktadekadienonsav= linolsav b) c) Megtalálhatóságuk: élő szervezetben kötött állapotban találhatóak meg. A palmitinsav és sztearinsav többnyire az állati zsírok, az olajsav a növényi olajok alkotórésze. Az olivaolaj csak olajsav-, a marhafaggyú pedig csak sztearinsavrészt tartalmaz. Növényekben több kettős kötést tartalmazó karbonsavak is előfordulnak kötött állapotban. Szerkezet Hosszú apoláris lánc végén található egy karboxilcsoport. Telítetteknél: a
konformáció miatt „tekereghet” Telítetlenek: a kettőskötés ott „síkbafeszít” és „megtöri” a szénláncot, így a másodrendű kapcsolatok nehezebben alakulnak ki. Fizikai tulajdonságaik. Op-Fp.: a telítettek szobahőmérsékleten kristályos vegyületek, a telítetlenek azonban ugyanilyen hőmérsékleten folyadékok. Op: sztearinsav: 90°C olajsav: 18°C linolsav: –5°C C/27 2000/2001. 10 a-b Bp d) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A telítetlen karbonsavak olvadáspontja alacsonyabb, mint az azonos szénatomszámú telítetteké, mert a kettős kötés „megtöri” a szénláncot, így a másodrendű kapcsolatok nehezebben tudnak kialakulni: Oldhatóság: A nagy szénatomszámú karbonsavak vízben nem, de apoláris oldószerekben jól oldódnak. A telítetlenek szénláncának telítése (i) Brómozás A telített szénláncú savak a brómos vizet nem színtelenítik el, de a telítetlen igen. Így
az olajsav addíciós reakcióba lép a brómmal: HC CH + Br 2 HC CH Br Br (ii) Hidrogénezés: lsd. később: Zsírok és olajok: olajkeményítés Katalizátor jelenlétében az olajsav a hidrogént is addicionálja. A reakciónak a növényi olajok „keményítésében” van szerepe. HC e) CH + H2 H2C CH2 Előállításuk: Az észter-típusú zsírok és olajok hidrolízisével állíthatóak elő. A reakciót lsd később A nevüket is innen kapták: palmitinsav: nevét a pálmazsírról, a sztearinsav: a görög „sztear”=faggyú, zsír szóból. Az olajsav a növényi olajokból állítható elő. C/28 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) VII. Fontosabb karbonsavak II (Vált 4 elemre: 314-) 1) Nem helyettesített egyértékű karbonsavak a) Alkánsavak: láttuk b) Telítetlen karbonsavak (Vált. 4: 330) (i) Olajsav O (ii) Linolsav H C C C (iii) Akrilsav: 2 H OH c) Aromás karbonsavak
(Vált. 4: 330) (i) Benzoesav: Az aromás gyűrűt tartalmazó karbonsavak közül a COOH legegyszerűbb. Fehér, kristályos anyag, vízben már gyengén oldódik. A trópusokon élő benzoefa izzadmánya benzoegyanta. Ennek a hevítésekor keletkezik egyebek közt a benzoesav. Belőle állították elő valamikor a benzolt (dekarboxilezéssel). Nátriumsója a nátrium-benzoát: az élelmiszeripar használja tartósítószerként. C 6 H 5 –COONa 2) Nem helyettesített dikarbonsavak, v. többértékű karbonsavak, (Vált 4: 331) a) Telítettek O O (i) Oxálsav (etándisav) C HO C OH Először is emlékezzünk: Ezt a reakciót Wöhler végezte el 1826 körül, s megdöntötte a visvitalis elméletet! A legegyszerűbb dikarbonsav. A sóskából vonták ki először, nevét a sóskafélék latin nevéről kapta: oxalis. Savassága: Két lépésben disszociál, az első disszociációban erősebb az ecetsavnál, de a másodikban már nem: logikus, a két karboxilcsoport erősen
elektronelszívó. Ha azonban az egyikről lehasadt egy proton, akkor az már inkább elektront küld, így a másik H már nehezen válik le! Sói: oxalátok: Savanyú káliumsója (HCOO–COOK) a vasionokkal vízben oldódó vegyületet képez, ezért ruhákból rozsdafoltok eltávolítására alkalmas. Vízben nem oldódó kálcium-oxalát képződik belőle, ha például kalciumion tartalmú vízzel keveredik. Ezért mérgező a szervezetre, hiszen vesekő kialakulását eredményezheti! C/29 2000/2001. 10 a-b Bp b) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (ii) Borostyánkősav (butándisav): (Acidum succinicum) A közönséges borostyánkősav a borostyánkőben COOH előfordul; innen a neve. A borostyánkő (succinit), ősvilági CH2 fenyőfáknak „ásatag” gyantája. rokon azzal a gyantával, CH 2 melyet a tűlevelű fák manapság is kiizzadnak. Az ősvilági fenyőfák gyantája a földbe kerülve, nagy idő multán kővé
COOH keményedett meg s ebben az alakban szerepel ma mint ásvány. Az élő szervezet anyagcsere-ciklusában van jelentősége. Telítetlen (i) A maleinsav és a fumársav: a két buténsav. O HOOC H H COOH H C C hevítés O - H2O HC C COOH H COOH H O maleinsav maleinsavanhidrid fumársav A Szent-Györgyi–Krebs - ciklus (más néven citromsavciklus = citrátciklus) fontos vegyülete. Szerepe a szervezet redox folyamataiban a borostyánkősavval együtt a hidrogénátvitelben van: E kettő sav mellé még néhány fontosabb, helyettesített savat fogunk megemlíteni a Szent-Györgyi – Krebs ciklusnál! (ii) Ftálsav: O COOH COOH hevítés - H2O C O C O ftálsav ftálsavanhidrid A ftálsavanhidrid az iparban az egyik legnagyobb mennyiségben előállított vegyület, főleg műanyagok gyártása céljából. C/30 2000/2001. 10 a-b Bp 3) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Helyettesített karbonsavak a)
Halogénkarbonsavak: már láttuk egy sorozatukat, + a trifluorecetsavat. b) Hidroxikarbonsavak (Vált. 4: 337) (i) Szalicilsav Nevét mindenütt ismerik, ahol nyáron otthon befőtteket tesznek el. Konzerválásra „szalicilt” szoktak használni. Lázcsillapító hatása van. Származéka az aszpirin, amit majd az észtereknél tanulunk Előállítása: O- Na+ OH OH nyomás COOH COONa erõs sav 120 C nátrium-fenolát nátrium-szalicilát szalicilsav (ii) Borkősav: (2,3-dihidroxi-butándisav): savanyú káliumsója a borkő, amely a hordók falára rakódik ki. A borkősavat, illetve sóit az élelmiszeriparban és a textiliparban használják fel. Sok fémionnal komplex sókat alkot. A sóit tartarátoknak hívjuk A Fehling-II reagens fontos összetevője! (iii) Tejsav (2-hidroxi-propánsav) HC CH COOH Szirupsűrű, vízzel elegyedő, színtelen, 3 OH kellemesen savanyú ízű folyadék. Az aludttejből fonható ki, ahol tejcukorból a tejsavbaktériumok hatására
keletkezik. A felhalmozódó tejsav miatt „megy össze” a tej A kazein nevű fehérje kicsapódik, aludttej, abból túró keletkezik. Hasonlóan erjedési folyamat eredménye a savanyúságban (pl. kovászos uborka) található, annak kellemes ízét adó tejsav. (iv) Citromsav (2-hidroxi-1,2,3-propántrisav) és almasav (hidroxiborostyánkősav) COOH COOH COOH COOH CH OH CH OH CH OH CH2 CH3 CH2 CH OH COOH COOH HO C COOH CH2 COOH tejsav almasav borkősav citromsav Az almasav és a citromsav a Szent-Györgyi - Krebs -ciklus fontos összetevői. A citromsav igen elterjedt növényi sav, mely a citromlében 5-7%nyi mennyiségben fordul elő. Ebben mutatta ki Scheele az 1700-as évek végén. Megtalálható az almában, körtében stb Ételízesítésre, textilszínezésre, vérkonzerválásra használják. C/31 2000/2001. 10 a-b Bp c) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Oxokarbonsavak (i) Oxálecetsav
(oxo-borostyánkősav): tagja a citromsavciklusnak. COOH C O CH2 COOH (ii) Piroszőlősav: a szénhidrátok és a fehérjék biológiai lebontásának és szintézisének egyik kulcsanyaga. A piroszőlősavból az élő sejtben különböző vegyületek képződhetnek: Az élesztőben található enzimek hatására a piroszőlősav dekarboxileződik, és acetaldehiddé alakul. Ebből redukcióval etil-alkohol képződik. Ez a szeszes erjedés A izmokban a piroszőlősav tejsavvá redukálódik. Ha ugyanis nagyon gyors erőkifejtésre van szükség (pl. futás), akkor a szervezet a véren át nem tud a az izmoknak elegendő oxigént juttatni ahhoz, hogy az ott felhalmozott szénhidrátot gyorsan szén-dioxiddá és vízzé égessék el, s így a kellő energiát fedezzék. Ilyenkor az izom a szénhidrátot levegő nélkül bontja le, de csak a tejsavig, s ebből az átalakításból fedezi a hirtelen szükséges energiát. Az izomban ez a képződő tejsav okozza az
izomlázat leggyakrabban azonban acetilcsoporttá és széndioxiddá oxidálódik. Az acetilcsoport C/32 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) VIII. Észterek 1) Def, elnev, csoportosítás (Kajt.II 88o) a) Definíció Észternek hívjuk azokat a szerves vegyületeket, O melyek molekuláiban az észtercsoport a jellemző funkciós csoport. Az észtercsoport az azonos R1 C O R2 szénatomhoz kapcsolódó oxo- és étercsoportból felépülő összetett funkciós csoport. b) Elnevezésük: Elnevezésüket csak akkor érthetjük meg könnyen, ha egy kicsit elővételezzük a keletkezésüket: A karbonsavészterek a karbonsavak és az alkoholokból származtathatjuk egy molekula víz kihasításával: Mivel a karbonsavészterek karbonsavak és alkoholok reakciójakor keletkeznek, ezért a nevük így származik. Egy észter ugyanis egy karbonsav és egy alkohol „éterének” tekinthető. Az ecet németül Essig,
így az „ecet-éter”, Es sig-äther rövidített alakja magyarosan az észter. A karbonsavból levezethető csoportok nevének ismeretében az észterek elnevezése könnyen megérthető: Az észtereket úgy nevezzük el, mint a karbonsavaknak olyan származékait, amelyekben a karboxilcsoport hidrogénatomját szénhidrogéncsoport helyettesíti. Így a nevük: alkil-alkanoát. (Vigyázat, igazából a két szénatom közti oxigén az alkoholból van!) Pl.: H C alkanoát csop. – alkilcsop alkil-alkanoát O alkánsav-alkil-észter H3C C O O CH3 metil-formiát hangyasav-metil-észter O C C2H5 etil-acetát ecetsav-etilészter O H3C C O c) O CH3 O metil-benzoát fenil-acetát benzoesav-metil-észter ecetsav-fenil-észter Csoportosítás: • A szervetlen (ásványi) savakból pedig a szervetlensav-észterek vezethetőek le. • A karbonsavakból levezethető észterek a karbonsavészterek Őket önkényesen egyszerű észterek; illetve „bonyolult savak és
bonyolult alkoholok” észterei csoportokra bonthatjuk. C/33 2000/2001. 10 a-b Bp 2) 3) 4) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A funkciós csoport szerkezete Az észtercsoport összetett funkciós csoport. Tulajdonságai eltérnek az őt alkotó két csoport tulajdonságaitól. Az észtercsoportban nincs hidrogén kötve oxigénhez, ezért hidrogénkötés nem tud kialakulni. Az oxocsoport oxigénje pedig nem olyan poláros, mint az ketonoké, sőt annyira sem, mint az aldehideké. Így kevésbé poláros a molekulának a funkciós csoportot tartalmazó részlete. Fizikai tulajdonságok a) Fp: alig nagyobb az étereknél, beszorul az éterek és aldehidek közé, hiszen csak gyengén poláros a funkciós csoport környékén a molekula. Az, hogy illatuk jól érezhető, éppen a könnyű párolgásuk miatt van! b) Oldhatóság: Az észterek eleve nem nagyon poláros vegyületek. A funkciós csoport hidrogénkötésnél csakis
akceptorként szerepelhet, ráadásul egy vízmolekula oxigénje polárosabb. Így a vízmolekulák hidrogénkötési rendszerébe nehezen épül be: már a legkisebb molekulatömegű észter, a metilformiát is csak korlátozottan elegyedik a vízzel. A nagyobb észterek pedig egyáltalán nem oldódnak vízben. Kémiája a) Előállítása általában Az észterképződés megfordítható, egyensúlyra vezető folyamat. Egy karbonsav és egy alkohol megfelelő egyensúlyig észterré és vízzé alakul, az észter pedig vízzel karbonsav és alkohol képződése közben hidrolizál. O O R1 + H O R2 C O b) H R1 + H2O C O R2 A reakciót egy nagyon kevés sav hozzáadásával lehet katalizálni. Vigyázat cc HCl-val is megy, vagyis ha cc. H 2 SO 4 -at használunk, akkor abból is elég néhány csepp, vagyis nem a kénsav „vízelvonó” hatása játszik szerepet, hanem a protonáló hatás. Ez a katalizálás mindkét irányban eredményes, vagyis nemcsak az
észterképződést segíti elő, hanem az észter hidrolízisét is. A sav katalizátor tehát „jól működik”: mindkét irányból gyorsítja az egyensúly beálltát, de egyik irányba sem tolja el a reakciót. Hogyan lehet valamelyik irányba eltolni a reakciót? Pl. feleslegben adagoljuk a kiindulási anyagot; vagy a terméket elvonjuk (észterképződésnél az észtert v. a vizet) Előállítása konkrét példán (i) Kísérlet: Figyelem: „kisózás” (ii) Megfigyelés Észterszag és két fázis jelenik meg. (iii) Reakció C/34 2000/2001. 10 a-b Bp c) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Észterek lúgos hidrolízise Mivel az észterképződés megfordítható folyamat, ezért ha az észtert víz feleslegben főzzük, akkor észterhidrolízis megy végbe. Ha a hidrolízist teljessé kívánjuk tenni, akkor a reakciót lúgos közegben kell végezni. Ez a folyamat már egyirányú, mert a az etilalkohol az
acetátionnal nem lép reakcióba. C2H5 O C CH3 + OH C2H5 OH + CH3 COO O 5) Az észterek lúgos hidrolízisét szokták szappanosításnak, „elszappanosításnak” nevezni, mert a zsíroknak mint észtereknek lúgos hidrolízisekor keletkező nagy szénatomszámú karbonsavak sói a szappanok. Észterek csoportjai a) Kis szénatomszámú észterek: Pfeiffer: 133. (i) Gyümölcsészterek Rövid szénláncú alkoholok és karbonsavak termékei. Többnyire kellemes illatú anyagok. A természetben mint a gyümölcsök aromaanyagai fordulnak elő. Mesterségesen is előállítják őket: likőraromát, oldószereket készítenek belőlük. (ii) Acetil–szalicilsav: Istopirin v. aspirin (Pfeiffer: 135; KajtII: 130) COOH b) c) COOH OH O + HO C CH3 O O C CH3 Láz és fájdalomcsillapító hatású. Ez így savas jellegű Kalciumsóját, a Kalmopyrint már a savra érzékenyek is szedhetik. Nagy szénatomszámú észterek: viaszok. A gyümölcsök héját vagy a bogarak
szárnyát bevonó, védő, finom viaszréteg szintén észtertípusú anyag. A méhviasz is ilyen: 80%-ban a palmitinsav és a miricil-alkohol (C 30 H 61 OH) észtere: miricil-palmitát: CH 3 –(CH 2 ) 14 –COO––CH 2 –(CH 2 ) 28 –CH 3 . Szervetlen savak észterei: az oxigéntartalmú szervetlen savak és alkoholok vegyületei. A legismertebb: a glicerin-trinitrát, vagy közismert nevén a nitroglicerin CH2 OH CH H O NO2 OH + H O NO2 CH2 OH H O NO2 NO2 cc. H2SO4 CH2 O CH O NO2 CH2 O NO2 Fojtott térben történő robbanása nagy feszítőerővel következi be, mert a nitroglicerin bomlástermékei gázok (a keletkező víz is gőzzé változik.) 2 C 3 H 5 (ONO 2 ) 3 6 CO 2 + 3N 2 +1/2O 2 + 5H 2 O C/35 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) IX. Zsírok és olajok 1) Definíciók: a) Gliceridek, trigliceridek: A glicerin észtereit glicerideknek nevezzük. Ezek közül azokat, amelyekben a
glicerin mindhárom hidroxilcsoportja acilezve van, triglicerideknek hívjuk (Furka 652:) b) Zsírok, olajok: A szilárd halmazállapotú, főleg sztearin- és palmitinsav-részletet tartalmazó, általában állati eredetű glicerideket nevezzük zsírnak, a folyékony, főleg linol- és olajsavval vannak acilezve, általában növényből származókat olajnak. (Pfeiffer: 135 + Kajtár 135:) c) Lipidek. A gliceridek a sejtekben levő egyéb vegyületekkel együtt (szteroidok, terpének, karotinoidok) főleg apoláris molekularészeket tartalmaznak, ezért vízben nem, csak ún. zsíroldószerekben (alkohol, éter stb) oldódnak Így az olyan sejtalkotó vegyületeket, amelyek vízben nem, csak zsíroldószerekben oldódnak, összefoglaló néven lipideknek nevezzük. (Kajtár 137; Pfeiffer 137) 2) Összetételük: (Z.Orbán: 97o) A glicerin három értékű alkohol, így három zsírsavmolekulával tud észtert képezni. A zsírsav lehet telített vagy telítetlen, de mindig páros
szénatomszámú karbonsav. A leggyakoribbak a palmitinsav, a sztearinsav, vagy az olajsavláncot tartalmazó gliceridek. O Pl. A glicerinnek a sztearinsavval, az olajsavval és a H2C O C C17H35 palmitinsavval adott észtere. O A zsírok szilárd halmazállapotú, többnyire állati eredetű HC O C C17H33 gliceridek. Molekulájuk főként palmitinsav-, illetve C sztearinsav részletet tartalmaz, vagyis telített savak H C O C C H 15 31 2 észterei. Az olajok folyékony halmazállapotú, főként növényi eredetű anyagok. Molekulájuk főleg telítetlen szénhidrogénláncot (olajsavrészlet) tartalmaz. Egy triglicerid-molekulában általában különböző karbonsav-részletek fordulnak elő, de van olyan triglicerid is, amelyben mindhárom acilező karbonsavrészlet azonos: Ilyen pl. a trisztearin (trisztearoil-glicerin) illetve a triolein (trioleoil-glicerin): Kajtár 135. O O H2C O C C17H33 O HC O C C17H33 C H2C O C C17H33 O HC O C C17H33 C H2C O C C17H33 H2C O C C17H33
trisztearin triolein C/36 2000/2001. 10 a-b Bp 3) 4) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Fizikai tulajdonságok a) Halmazállapot: A zsírok szilárdak, az olajok folyékonyak: adódik ez ugyanabból az okból, ami miatt a nagy szénatomszámú telített zsírsavak szilárdak (pl.: sztearinsav), a telítetlenek folyadékok (pl: olajsav) Vagyis a telítetlenek a bennük található „törés” miatt nehezebben rendeződnek egymás mellé, mint a telítettek, így nehezebben alakulnak ki a molekulák között a szilárd halmazállapotot biztosító másodrendű kapcsolatok. Ráadásul mivel a zsírok is, olajok is általában többféle gliceridekből állnak, ezért nincs pontos, meghatározott olvadási pontjuk, amorf anyagok. b) Oldhatóság: vízben, apoláris oldószerekben A gliceridek molekulái gyakorlatilag apolárisak, (a hosszú szénhidrogénlánc hatása), ezért vízben, poláros oldószerekben nem oldódnak. Apoláris
oldószerekben azonban (alkohol, benzol, éter) kitűnően oldódnak. Kémiai tulajdonságok: a) Katalitikus hidrogénezés Az olajokat hidrogénezéssel (katalizátor segítségével történő hidrogénaddíció) szilárd zsiradékká lehet átalakítani. Lsd VI/2/e/ii: telítetlen zsírsavak hidrogénaddíciója. Ez a folyamatot nevezik „olajkeményítésnek”. Így állítanak elő növényi olajokból margarint b) „Avasodás” Ismert káros tulajdonsága a zsíroknak és olajoknak, hogy a levegőn rövidebb-hosszabb idő alatt megavasodnak, amikor is csípős ízt és kellemetlen szagot kapnak. E változás alatt a zsírok kémhatása savanyúvá válik. Az avasodás nem minden zsírnál és olajnál következik be egyenlő mértékben és egyenlő idő alatt. Jórészben függ ez a zsír tisztaságától, a környezet nedvességétől, többé-kevésbé a hőmérséklettől és a fényhatásoktól. Az avasodás alkalmával a víz és az oxigén hatása alatt keletkező
zsírsavak, továbbá aldehid- és ketonszerű termékek okozzák a szagot. A világosságtól védett és száraz környezetben, lehetőleg sötétben tartott zsírok és olajok hosszabb ideig ellen tudnak állni az avasodásnak, főként, ha a levegőtől teljesen elzárható edényben tartjuk azokat. c) Szappanosítás: A trigliceridek lúggal (vizes NaOH oldattal) főzve glicerinre, és a megfelelő karbonsavak nátriumsóira hidrolizálnak. Az utóbbiak a szappanok. O CH2 C CH2 OH O R1 O CH C O R2 O R3 3Na+OH– víz OH CH2 OH O CH2 C R 1 –COO–Na+ R 2 –COO–Na+ + R 3 –COO–Na+ CH Zsírsav-Na-só „szappan” C/37 2000/2001. 10 a-b Bp d) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Polimerizálódás; A száradó olajok: A sok telítetlen kötést tartalmazó olajok – pl. a lenolaj, amelynek fő zsírsavkomponense a linolsav és a linolénsav – levegőn az oxigén hatására polimerizálódnak. A
különböző molekulák telítetlen láncai – általában a telítetlen kötés melletti szénatomokon át vagy az olefinkötésű részletek kapcsolódása útján – összekapcsolódnak egymással, s így térháló szerkezetű óriásmolekulák jönnek létre. Ez egy bonyolult folyamat, az olaj száradásának hívják. Az eddig ismertetett zsiradékokon kívül fontos szerepet játszanak még a gyakorlati életben a száradó olajok. Ezek jellegzetes képviselője a lenolaj, melyet lenmagvakból préseléssel, vagy kivonással nyernek. Lenolajon kívül száradók még a kender, mák, dió stb Nálunk a lakk-, kence-, mázoló- és linóleumipar elsősorban a lenolajat használja. Száradóknak nevezzük általában azokat az olajokat, amelyek a levegőn tartva megsűrűsödnek, száraz állományúak lesznek, tehát vékony rétegben fölkenve a felületen kemény rugalmas réteget (filmet) képeznek. A lenolaj összetételére olajsavból, linolsavból és linolénsavból
áll, mely savak, mint telítetlen vegyületek olyan tulajdonsággal bírnak, hogy a levegőből oxigént képesek fölvenni, azt megkötik, miközben megszilárdulnak „beszáradnak”. C/38 2000/2001. 10 a-b Bp X. Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Szappanok és mosószerek 1) Def.: A nagy szénatomszámú karbonsavak nátrium- vagy káliumsói a szappanok. 2) Szerkezetük: Mivel a szappanok a nagyszénatomszámú karbonsavak sói, ezért vízben oldva ionjaikra disszociálnak. A anion hosszú szénlánca apoláris, a vízmolekulákat taszítja, a negatív töltésű karboxilát-ion rész viszont a vízmolekulákat vonzza. Az apoláros részt hidrofóbnak (víztaszító gr.), a poláris részt hidrofilnek (vizet kedvelő gr.) nevezzük 3) Fizikai tulajdonságok: csak a felületaktív tulajdonságának vizsgálatakor nézzük. 4) Kémiájuk a) Előllítás (Pfeiffer 138.) Már az ókoriak tudták, hogy zsírok és alkáliák
(szóda=sziksó=Na 2 CO 3 , „lúgkő”=NaOH) együttes főzésekor olyan anyag keletkezik, amely növeli a víz tisztítóhatását. Ezeket az anyagokat szappannak nevezték A 12 századtól Európa-szerte elterjedt, háziiparrá fejlődött a szappangyártás. Ma már szinte kizárólag vegyi üzemekben készülnek a legváltozatosabb minőségű szappanok. Az iparban a szappangyártás során a zsírok hidrolízisét magas hőmérsékletű vízgőzzel és katalizátorral végzik: O CH2 C O C17H35 O C17H35+ 3H 2 O O C17H35 O CH C CH2 OH Kat. Hõ CH OH+3C 17 H 35 COOH CH2 OH O CH2 C trisztearin + vízgőz glicerin sztearinsav A keletkezett zsírsavakat elválasztják a glicerintől, majd nátrium-karbonáttal (szódával) szappanná alakítják: 2 C 17 H 35 COOH + Na 2 CO 3 = 2 C 17 H 35 COONa + H 2 CO 3 Az így nyert szappanhoz lágyító- és illatosító anyagokat adnak, majd formába öntik. A zsírsavak nátriumsói (nátronszappan) kemény szappanok, a
káliumsói viszont lágyak, ilyen a kenőszappan (káliszappan). b) Kémhatásuk: A szappanok gyenge savak sói, ezért vízben részben hidrolizálnak, oldatuk lúgos kémhatásúak: C 17 H 35 COO– + Na+ + H 2 O ⇔ C 17 H 35 COO H + Na+ + OH– Emiatt sajnos károsítják a bőrt illetve kemény vízben, melynek sok a Ca2+ és Mg2+ tartalma, csapadékot képeznek: Ca(C 17 H 35 COO) 2 . Így hatásuk csökken. C/39 2000/2001. 10 a-b Bp 5) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A szappanok és mosószerek tisztító hatása a) Def.: Felületi feszültség: Az az energia, amelyet akkor kell befektetnünk, amikor egy folyadék felületét egységnyi felülettel növeljük. Jele: α Mértékegysége: J/m2 N/m „Képzeljük el, hogy egy végtelen finom csipesszel benyúlunk a folyadék belsejébe, és onnan kiemelünk egy molekulát. Ismételjük meg ezt a műveletet egy olyan molekulával, amelyik a folyadékcsepp felszínén foglal
helyet. Ez a felületi molekula nincs minden oldalról szomszédokkal körülvéve, csupán alatta vannak folyadékmolekulák. Ezért kevesebb munkát kell végeznünk akkor, ha ezt a felületi molekulát akarjuk a megegyezésünk szerinti <zérushelyre> vinni.” Gamow: 272 b) Felületaktív anyagok (i) Oldódásuk, majd elhelyezkedésük a vízben. Kevés szappan oldódásakor a nagy apoláros résszel rendelkező molekulák előbb utóbb „kitaszítódnak” a víz felületére, s „imbolygó bójákként” emelkednek ki a számukra kényelmetlen környezetből a levegőbe. „Horgonyuk” a negatív töltésű részletük, amely a vízben jól oldódik. Ha már elég sok anion van egymás mellett, akkor azok apoláris felükkel vonzzák egymást, s egymással párhuzamosan és a felületre merőlegesen helyezkednek el. Már így csökken a víz felületi feszültsége, hiszen gyakorlatilag nincsenek vízmolekulák a felületen. Töményebb szappanoldatban a szappan
részecskéi, ionjai a hosszú hidrofób résszel a vízmolekulák közé furakodva megbontják a vízmolekulák közti hidrogénkötéseket, ezért így is csökkentik a felületi feszültséget. (A felületi feszültséget csökkentő hatás lesz a felületaktív anyag fő jellemzője!) Ui.: könnyebb most már a folyadék felületére kivinni a belül elhelyezkedő molekulát, hiszen az nem köt olyan erősen, vagyis csökkent a felület növeléséhez befektetendő energia. (ii) Micellák: Ráadásul a töményebb szappan-oldatban, amelyben az összes oldott részecske már nem fér el a víz felületén, a víz belsejében kénytelenek „úszkálni”, amíg össze nem terelődnek. Ekkor úgy helyezkednek el, hogy az apoláris részüket befelé tartva diszperziós kötéssel kapcsolódnak egymáshoz, és a poláros részüket kifelé tartva a vízzel dipólusdipólus kötést létrehozva gömbökbe, vagy ha már többen vannak, lemezkékbe rendeződnek, melyek a gömböknél
nagyobb felületűek. Def.: A folyadék belsejében létrejött halmazokat (asszociátumokat) micelláknak nevezzük. C/40 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (iii) A habképződés: Ha töményebb szappanoldatot jól összerázunk, akkor dús hab képződik a felületén. Mi ennek az oka? A zsírsavsó- és vízmolekulákból álló rendszer számára az az állapot a legkedvezőbb, ha a zsírsavsó molekulái a víz felületén helyezkednek el. Csakhogy a víz térfogatához képest a felülete nagyon kicsi. Ezt növeli meg a hab A zsírsavsó molekulái kilökődnek a hab felületére, s a vékony vízhártyákat kívül-belül monomolekulás réteg borítja be, ami stabilizálja a felületet, a habot. A szappanbuborék fala így folyékony kristálynak tekinthető. Mechanikailag ui a folyadékokhoz hasonló, hiszen láthatóan folyik, a benne elhelyezkedő anionok viszont – a szilárd kristályokhoz
hasonlóan – hosszútávú rendezettséget mutatnak. Érdekesség, hogy a felületi feszültség miatt a hártyák a minimálfelületre törekszenek, ugyanakkor a felületaktív anyag számára a nagy felület a kényelmes! c) (iv) Def: Felületaktív anyagok.: Az olyan anyagokat, amelyek monomolekuláris rétegek kialakítása útján a folyadékoknak - habképzés révén megnövelt felületét stabilizálni képesek, felületaktív anyagoknak nevezzük. A tisztítás mechanizmusa Ezek után vizsgáljuk meg, hogy tisztítanak a szappanok, illetve más felületaktív mosószerek! A ruhaneműkhöz a viselés során zsír tapad, s ebben a por, a korom, a szennyeződés könnyen megtapad. A tiszta víz erről lepereg. Ha azonban felületaktív anyaggal együtt mossuk, akkor a felületaktív anyag molekuláinak az apoláris része – ahogy a víz felületéből is kilóg – a zsírba, mint számára kedvező apoláris közegbe, belefúródik úgy, hogy az ionos része a vízben
marad. A zsírfolt fellazul, s mindenhol körbeveszik ezek a molekulák. Így már egy nagy micella jelenik meg a vízben, amely kifelé poláros, belül egy zsírfolt van, s ez már nem tapad vissza a ruhára. Természetesen mozgatni kell a mosás közben a ruhát, egyébként ez az oldatbavitel nagyon lassú lesz! C/41 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) XI. A szerves vegyületek szaga: Kajt: Vált 4 elem: 295o) XII. A konfigurációs izoméria 1) Ism. Lsd B/V/6: térizoméria v sztereoizoméria 2) A szőlősav felfedezése (Balázs: 541) + Pasteur + saját füzet vége fele: rajzzal! 3) A konfiguráció: Kajtár Vált. 4 elemre: 429 o teteje 4) A konfigurációs izoméria: Kajtár II. 160 5) Kiralitás: Kajtár: II. 161-162 6) Több kiralitás centrum: Kajtár: II. 163-164 C/42
(ii) Szénlánc felépítése szerint: telített, telítetlen, nyíltláncú, gyűrűs (iii) A hidroxilcsoport helyzete szerinti csoportosítás: rendűség 1. rendű: primer butan-1-ol 2. rendű: szekunder izopropil-alkohol propan-2-ol 3. rendű: tercier: izobutli-alkohol 2-metilpropan-2-ol (iv) A propan-1-ol homológ sora Többféle homológ sor is lehetséges. Az alkánokból: alkanol-ok C n H 2n+1 –OH CH 3 CH 2 CH 2 CH 2 OH H3C H C CH3 OH CH3 H3C C CH3 OH C/1 2000/2001. 10 a-b Bp b) c) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Elnevezések Az alkán neve után -ol végződés teszünk. A hidroxilcsoport helyzetét számmal jelöljük. Az alkoholok funkciós csoportjának elektronszerkezete (Kajtár: Vált. 4 elemre:271o) „Nagy hiba lenne, ha valaki egy alkohol általános képletét látva azt gondolná, hogy maga az alkohol olyasféle vegyület, mint egy „lúg”, pl. a nátrium-hidroxid, mert mind a kettőben
„hidroxi.” van R–OH Na–OH Na+ OH– jó rossz jó A két vegyület között óriási különbség van! Az alkoholban a hidroxilcsoport kovalens kötéssel kapcsolódik az alkilcsoport egyik szénatomjához. A két csoport egyetlen molekula két részlete; a csoportokat csak mi különítjük el gondolatban. A nátrium-hidroxid ezzel szemben ionos vegyület, amelynek igazából nincs molekulája, hanem a kristályrácsban független nátriumionok és hidroxidionok helyezkednek el egymás mellett. Az OH– ion külön, önmagában is létezik, a OH– csoport nem, az csak részlete egy alkohol molekulának. Sőt: d) ∆EN O–H = 1,4 ∆EN C–H = 0,4 Vagyis az O–H kötés polározott, inkább a H+ proton tud leszakadni, vagyis nagyon erős lúgokkal szemben (Na igen, NaOH már nem!) savként viselkedik. Az alkoholok fizikai tulajdonságai R–OH : a szénlánc és a OH– csoport együttesen befolyásol: C C C C OH apoláros poláros Mennél hosszabb az
apoláros rész, annál jobban az a meghatározó, viceversa. Ez mind az oldhatóságnál, mind az Op-Fp-nál megvan! A hidroxilcsoport oxigénjének van nemkötő elektronpárja, a hidrogén pedig egy nagy EN-ú atomhoz (oxigén) kapcsolódik, így minden feltétel megvan a hidrogénkötés, a hidrogén híd kialakulásához. Ez nagyon erősen befolyásolja a fizikai tulajdonságokat! Oldhatóság: Kis C atomszám esetén a hidroxilcsoport a befolyásoló: hidrogénkötés jöhet létre a víz és az alkohol molekulák között. Így a kis szénatomszámú alkoholok jól oldódnak vízben. A nagy szénatomszámúaknál azonban már az apoláros rész befolyásol, s így egyre kevésbé oldódnak vízben. C/2 2000/2001. 10 a-b Bp e) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Op–Fp Az Op–Fp-nél is erősen befolyásol a hidrogén kötés. A kis szénatomszámú alkanolok Fp-ja jóval nagyobb, mint a hozzá hasonló tömegű paraffinoké:
ugyanis un. asszociátumok alakulnak ki, s úgy viselkednek, mintha „nagyobbak” lennének a molekulák: ∆Fp Vegyület Fp Vegyület Fp 65 C2H6 –88 153 CH 3 –OH C 2 H 5 –OH 78 C3H8 –42 120 97 C 4 H 10 0 97 C 3 H 7 –OH 118 C 5 H 12 36 82 C 4 H 9 –OH 138 C 6 H 14 68 70 C 5 H 11 –OH Megfigyelhető, hogy mennél nagyobb az apoláris lánc, annál kevésbé befolyásol a hidroxilcsoport, ergo: kisebb az Fp-ok közti különbség. Természetesen a többértékű alkoholok több hidrogénkötést tudnak kialakítani, így ott még nagyobbak a különbségek: Vegyület Fp Vegyület Fp ∆Fp HO–CH 2 CH 2 –OH 198 C 4 H 10 0 198 glicerin 290 3-metilpentán 63 227 Az alkoholok kémiai tulajdonságai + reakciók (i) A savasságra visszavezethető reakció • Az alkoholok vízzel szemben azonban „semleges” vegyületnek mondhatóak, mert az alkohol-molekulák gyakorlatilag nem adnak át és nem is vesznek föl protont a víztől. • Még NaOH -dal sem reagálnak
Összefoglalva: az alkoholok nagyon gyenge savak, még a víznél is gyöngébbek. (Láttunk már ilyet: pl: acetilén) (ii) Reakció nátriummal • Az alkoholok nátriummal hidrogénfejlődés mellett nátriumsókká alakulnak át: ezek neve: nátrium-alkoholát. Pl: CH 3 CH 2 –OH + Na CH 3 CH 2 –O:– + Na+ + ½ H 2 Azonban ez nem egy igazi sav-bázis reakció: A lehasadó protont nem egy bázis köti meg a nemkötő elektronpárjával, hanem a nátrium átad neki egy elektront, s így a protont hidrogénné redukálja, miközben maga Na+-ná oxidálódik! Vagyis ez igazából: redoxi-reakció! A nátrium-alkoholátok ionos vegyületek ⇒ vízben oldódnak. vizes oldatuk lúgos kémhatású: ← R–O:– + H–OH R–OH + OH– (iii) Reakció erős savakkal: C/3 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A molekulában kötött oxigénatomnak mindig van nemkötő elektronpárja, ezért erős savakkal
szemben (HCl; H 2 SO 4 ) bázisként viselkedhet. Lássuk először, hogy viselkedik a víz: Éppígy viselkedik az alkohol is: protonálódik. Ebben a sav-bázis reakcióban ő a bázis 1 . Protonált állapotban az alkoholok (és az éterek) különleges reakcióban vehetnek részt: A fenti egyenlet szerint a fordított irányban az történik, hogy a kloridion egy protont hasít le egy szénhidrogéncsoporttal helyettesített oxóniumionról. Az is megtörténhet, hogy a kloridion egy szénhidrogén-kationt szakít le a pozitív oxigénatomról! Ezért tömény sósavval főzve az alkoholok alkil-kloriddá és vízzé alakíthatóak át. Így lehet alkoholokból alkil-halogenideket képezni. (iv) Oxidációjuk: lsd. aldehidek, ketonok (v) Éterképzés lsd. éterek (etanolból keletkezhet etén is!) (vi) Észterképzés lsd. karbonsavak C/4 2000/2001. 10 a-b Bp 3) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A fenolok a) A fenolok
funkciós csoportjának elektronszerkezete A fenolokban: Ar–OH : a hidroxilcsoport közvetlenül az aromás gyűrűhöz kapcsolódik. Így a fenolos hidroxilcsoport-ban az O–H kötés polárosabb, mint az alkoholos hidroxilcsoport-ban Ez nagyon jól megmagyarázza mind a fizikai, mind a kémiai tulajdonságait. b) A fenolok fizikai tulajd. Pl konkrétan a fenol Oldhatóság Vízben egy kicsit oldódik, de még mindig jobban, mint a neki megfelelő aromás vegyület. Az oldhatóság a hidroxilcsoportok számától függ Op-Fp: általában kristályos anyagok, a fenol Op-Fp je jóval magasabb, mint a neki megfelelő toluolé: a hidrogénkötés az ok. c) A fonolok kémiai tulajd. + reakciók (i) A savasságra visszavezethető reakció • Vízzel: OH + H2O O + H3O+ Sőt, a víznél erősebb savak: ez a reakció ezerszer gyakoribb, mint a víz öndisszociációja! • A következő reakció is ezt mutatja: Ar–OH + Na+ + OH– C 6 H 5 O:– + Na+ +H 2 O. fenol nátrium-hidroxid
nátrium-fenolát víz Vagyis vizes oldatban a nátrium-hidroxiddal sót képez! (Emlékszünk: ha a víz erősebb sav lenne, ez vizes oldatban nem történne meg, mert akkor víz hatására kiszorulna a sójából!) • Nátrium-hidrogénkarbonáttal szemben azonban már nem elég savas, vele reakciót nem ad! (ii) Oxidációjuk: lsd. később C/5 2000/2001. 10 a-b Bp II. Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Fontosabb alkoholok, fenolok 1) Etanol (etil-alkohol, borszesz) a) Általában Víztiszta, kellemes illatú folyadék. A kereskedelemben: „tiszta szesz”=96%-os etanol. A vízmentes, absz alkohol: 100%-os b) Szerkezet CH 3 CH 2 –OH Az alkoholok általános jellemzése után c) Tulajdonságok Az alkoholok általános jellemzése után szinte minden tulajdonság kitalálható: Vízzel korlátlanul elegyedik. Jól oldja a zsírokat, olajokat is Op: –114 °C, Fp: 78°C d) Reakciói: (i) Égés: C 2 H 5 –OH + 3O 2 2CO 2 + 3H
2 O ∆ r H=–1365 kJ/mol ⇒ üzemanyag! Kékes lánggal ég. (ii) A nátriummal adott reakcióját már ismerjük: redoxi reakció! 2C 2 H 5 –O-H +2Na 2C 2 H 5 –O– + 2Na+ + H 2 ↑ etilát-ion nátrium-etilát e) Előállítás (i) Természetes: szeszes erjedés: A cukortartalmú gyümölcsök levéből a levegőben lévő élesztőgombák enzimjei hatására alkohol keletkezik. A felszabaduló energiát az élesztőgombák az életfolyamataikhoz használják fel. enzim C 6 H 12 O 6 2C 2 H 5 –OH + 2 CO 2 Erjesztéssel legfeljebb 15%-os alkohol-oldat állítható elő: töményebben már az élesztőgombák elpusztulnak. Lepárlással: 96%-os elegyig lehet eljutni. Tovább nem, mert itt ugyanolyan a gőzfázis összetétele, mint a folyadékfázisé. „Azeotrop” elegy. Alkoholos levek lepárlásakor (pálinkafőzés) az esetleg kis mennyiségben jelen lévő metil-alkohol, alacsonyabb forráspontja miatt, az első cseppekben távozik („rézeleje”), ezrét
ezt meg kell semmisíteni. A régi telepítésű, ún. direkttermő szőlőből (pl: nova) készült borok jelentős mennyiségű faszeszt tartalmazhattak. Általános nézet, hogy az első, valóban „mesterséges” alkoholos ital a sör volt, mert a földművelésre való áttéréskor leginkább gabonát, árpát termesztettek és tároltak. Ez tároláskor kicsírázhatott, s megerjedhetett. A sör mellett szólnak azok a legrégebbi írásos emlékek is, amelyeket Egyiptomban és Mezopotámiában találtak. C/6 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Alkohol tart. ital Alk. tart t% alapanyag sör 3-8 árpa, komló bor 5-14 szőlő likőrök 20-40 alkohol, cukor, aroma égetett szeszek 40-80 konyak bor whisky rozs vodka burgonya, gabona gyümölcspálinka barack, körte, cseresznye stb. rum cukornád Tovább, töményebb alkoholig vízelvonó szert felhasználva lehet jutni. (ii) Ipari: • Földgázból
kiinduló Eténből: Az etén általában krakkgázként áll elő! Lsd: B/V/4/b/iii Acetilénből: az acetilén a metán hőbontásából áll elő 2) • Kőszénből: Kőszénből szintézisgázt készítenek, abból metanolt, majd a metanolból etanolt. (metanolkészítés lsd ott) CH 3 OH + CO + 2H 2 CH 3 CH 2 OH + H 2 O f) Felhasználás Főleg: Étkezés hatásai, szonda Vegyipar: oldószer, extrahálószer. Üzemanyag: nem környezetszennyező üzemanyag benzin helyett! Denaturálás: A nem étkezési célra használt alkoholt (oldószer, borszeszégő) emberi fogyasztásra alkalmatlanná teszik: kis mennyiségű piridin hozzákeverésével „denaturálják.” Metanol a) Általában + szerkezet: lsd. etanol b) Tulajdonságok: lsd. etanol c) Előállítás E század elejéig kizárólag a fa száraz desztillációjából állították elő. Ma már: Túlnyomó részben szintézisgázból készül: katalizator d) CH 3 OH CO + 2H 2 Felhasználás Kitűnő oldószer; jó
energiaforrás, üzemanyag: jó oktánszámú, kipufogógázai tiszták; egyéb vegyület kiindulási alapanyaga. C/7 2000/2001. 10 a-b Bp e) 3) Méreg: halálos adagja: testsúly-kilogrammonként kb. 30 mg Már kevés is fejfájás, hidegrázást okoz. Több: vakság, halál Glikol (etán-1,2-diol) a) A nevét a glicerinnel együtt a görög „glüküsz” = édes szóból kapta: édes ízűek. H2C OH b) Szerkezete c) 4) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) H2C OH Fizikai tulajdonságok A sok és erős hidrogénkötés miatt: jól oldódik vízben Op–Fp: magas nagy viszkozitás d) Felhasználása: jó fagyálló anyag: pl. 60 térfogat-százalékos vizes elegye csak –60°C-on fagy meg: autókba való fagyálló H2C OH Glicerin (propán-1,23-triol) a) Szerkezete HC OH b) c) H C OH 2 Fizikai tulajdonságok A sok és erős hidrogénkötés miatt: jól oldódik vízben Op–Fp: magas nagy viszkozitás higroszkópos
Felhasználása: • Az erős nedvszívó hatása miatt: A kozmetika iparban: hidratáló krémek készítéséhez használják: megakadályozza a bőr kiszáradását azáltal, hogy megköti a levegő nedvességtartalmát. (A magas glicerintartalmú krémek viszont éppen szárítják a bőrt, mert abból is kivonják a vizet.) A bélyegzőpárna-festéket is ebben oldják: megakadályozza a párna kiszáradását • A nitroglicerin (lsd. később): ütésre, melegítésre könnyen robban Porózus anyaggal (kovaföld, fűrészpor) felitatva biztonságos: dinamit. A robbanást a bomláskor történő nagy térfogat-növekedés idézi elő. A szerves robbanószereknél az éghető anyagokat és az égéshez szükséges oxigént is magába a molekulába építették össze, ami a keverékeknél közvetlenebb érintkezést és nagyobb égési sebességet biztosított. A nitrátok ilyen szempontból alkalmas vegyületek! (A nitroglicerin igazából nem nitrát, hanem észter!) Nobel
1867-ben fedezi fel a dinamitot (dünamisz=erő (gr)) Előtte sok baleset: Először egy robbanáskor az egyik testvére meghal, a másik megsérül. ⇒ A svéd hatóságok megtiltották hogy lakott terület mellett dolgozzanak ⇒ hajón van az üzem. Később: A New York-i Greenwich Streeten, a Hotel Wyoming portása egy vendég ládáját – mert vörösbarna gőzök szálltak fel C/8 2000/2001. 10 a-b Bp 5) 6) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) belőle, – kivitte a szálloda elé. Pillanatokra rá óriási kráter tátongott a helyén • A nitroglicerin gyors és erős értágító hatása miatt jó szívgyógyszer is (Nitromint) d) A glicerin az állati zsírok és a növényi olajok alkotórésze: lsd. később Koleszterin A koleszterin sokgyűrűs, HO kristályos vegyület, alkohol. A gerincesek szöveteiben található Először az epekőből különítették el. Van olyan epekő, amely majdnem tiszta kristályos
koleszterin. Innen a neve: „kholé” (görög) = epe, „sztereosz” = kemény Az élő szervezetben 6 izoprén-egységből álló molekulából (szkvalén) képződik, több lépésen át. Az ábrából látható, hogy ő is szteránvázas vegyület! Mentol: az egyik legismertebb terpénalkohol. Kristályos anyag: op: 43°C Hűvös, üdítő ízéről mindenki ismeri. A gyűrűs ciklohexán hidroxiszármazéka: a gyűrűhöz még egy metil és egy izopropil csoport kapcsolódik. OH 7) OH A második képleten jól látszódik a két izoprén-rész ⇒ terpénalkohol Fenol (karbolsav) a) Általában: Színtelen, kristályos anyag: levegőn állva pirosra, majd barnásvörösre színeződik Mérgező hatású: a mikroorganizmusokat elpusztítja⇒régen fertőtlenítésre használták. Bőrre kerülve veszélyes, hosszantartó égési sérüléseket okoz. b) Szerkezet: láttuk c) Fiz. tul: láttuk d) Kém. tul: láttuk e) Felhasználás: Vegyipari alapanyag: gyógyszerek (fenol
szalicilsav aszpirin), növényvédő-szerek, festékek, műanyagok. A kátrány a fenoltartalma miatt alkalmas fakonzerválásra. A húsok, kolbászok füstölésekor is a fenol az egyik konzerváló anyag. C/9 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) III. Éterek 1) Definíciójuk és elnevezésük Def.: Az éterek azok az oxigéntartalmú szerves vegyületek, melyek molekuláiban az oxigén 1-1 szénatomhoz kapcsolódik. Elnevezésük: „R 1 – R 2 – éter”. A két szénhidrogéncsoportot ábécé sorrendben írjuk fel. Pl.: C 2 H 5 –O– C 2 H 5 H 3 C–O– CH 3 CH 2 H 3 CH 2 C–O– CH 3 CH 2 dietil-éter etil-metil-éter 2) A funkciós-csoport szerkezete (Vált 4: 287.o) A molekula egy csak kismértékben dipólusos. Ugyanis nem túl nagy a ∆EN és ráadásul majdnem „bot” alakú a molekula, úgyhogy az eredő-vektor nem túl nagy! A hidrogén kötés két feltétele nincs meg: a hidrogén a
C-hez kapcsolódik. De ott van az O, ami nagy EN-ú és ∃ nemkötő elektronpárja, vagyis lehet akceptor. ⇒ más, megfelelő molekulákkal képes hidrogénkötést kialakítani 3) 4) Fizikai tulajdonságok a) Op-Fp Alig tér el a neki megfelelő szénhidrogéntől: (éter-csoport ↔metilén csoport), ui.: nagyon kis mértékben dipólusos Hidrogénkötésre meg végképp alkalmatlan. Tehát alapvetően diszperziós erők tartják össze, és egy kis dipólus-dipólus vonzás. pl.: b) Oldhatóság Az éter molekulák egymás közt nem, de mással alkothatnak hidrogénkötést. Így pl a vízzel Ez azonban gyengébb, mint a víz-víz közti H. kötés ⇒ csak kis mértékben. Valóban: pl: 1 cm3 éter 10 cm3 vízben Kémiai tulajdonságok a) Előállítás: konkrétan az éter: Vált 4. : 816 o + Kajt: IIo 113o Az etilalkohol közönséges hőmérsékleten: tömény kénsavval reagálva etilhidrogén-szulfáttá alakul át. Ez alakul tovább hőmérséklettől függően: Így
csak szimmetrikus éter állítható elő. Nem szimmetrikus: R–Cl + Na+ –:O–R’ R–O–R’ + NaCl alkil-halogenid + nárium-alkoholát C/10 2000/2001. 10 a-b Bp b) 5) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Reakció erős savakkal: Kajt.: IIo 107o + Vált 4: 288-289 Az alkoholokhoz hasonlóan az éterkötést létrehozó oxigén szintén megköthet protont. ⇒ Erős savval főzve: alkilkloriddá és alkohollá alakítható. (A képződött alkohol még tovább alakul alkil-kloriddá!) dietil-éter („éter”) a) Általában: Köznapi használatban az „éter” a dietil-éter. Színtelen, jellemző, bódító szagú, könnyen párolgó, alacsony Fp-ú folyadék. Rendkívül tűzveszélyes, levegővel robbanóelegyet képez! b) Szerkezet: láttuk c) Fiz. tul: láttuk d) Kémiai tul.+ reakciók: Égése: (C 2 H 5 )O + 6O2 = 4CO 2 +5H 2 O Képződése: láttuk Reakciója sósavval: láttuk e) Felhasználás: Régen altatásra
használták, ma már csak állatkísérleteknél alkalmazzák. C/11 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) IV. Az oxovegyületek 1) Definíció, és csoportosítás Az oxovegyületek azok az oxigéntartalmú szerves vegyületek, melyek molekuláiban az oxigénatom mondkét kötő vegyértékelektronjával ugyanazon szénatomhoz kapcsolódik. 2) 3) Az oxocsoport elektronszerkezete Az oxigén nagyobb elektronvonzó képessége a karbonilcsoportban még jobban érvényesül, mint az eddig megismert csoportoknál, hiszen a π-kötés könnyebben polarizálható, mint a σ-kötés. Ennek következtében az oxovegyületek reakcióképesebbek, mint az alkoholok vagy az éterek. Aldehidek a) Definíciójuk és elnevezésük Az aldehidek Olyan oxovegyületek, melyek molekulájában az oxocsoport elsőrendű – láncvégi – szénatomhoz kapcsolódik, tehát formil-, vagy más néven aldehidcsoportot tartalmaz. O
Általános képletük: C n H 2n+1 – CHO v. R – CHO A funkciós csoportot a molekulában mindig külön R C tüntetjük fel, de az elnevezéskor a molekula szénatomszámába H beleszámít! Elnevezés: a megfelelő szénatomszámú alkán nevéből „–al” végződéssel: pl: C 2 H 5 –CHO H–CHO CH 3 –CHO metanal etanal propanal formaldehid acetaldehid b) c) A funkciós-csoport szerkezete: láttuk Fizikai tulajdonságok (i) Op-Fp A karbonilcsoport erős polárossága miatt – a ketonokkal együtt – a megfelelő éternél nagyobb az Fp, de a megfelelő alkoholnál kisebb: hiszen a hidrogénkötés kialakulásának nincs meg a feltétele. C/12 2000/2001. 10 a-b Bp d) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (ii) Oldhatóság Hidrogénkötést képes kialakítani a vízzel, ez elősegíti az oldhatóságát. Ahogy azt már az alkoholoknál láttuk, az oldhatóság ugyanolyan oknál fogva kezdetben jó, majd a szénatomszám
növekedésével csökken. Kémiai tulajdonságok Reakciókézsége – ahogy azt a karbonilcsoport szerkezetének vizsgálatakor már láttuk – nagyobb, mint az alkoholoké és étereké. (i) Előállítása: alkohol oxidációjával, dehidrogénezéssel. Az aldehideket elsőrendű alkoholokból lehet előállítani oxidációval, jelen esetben hidrogénelvonással. Ezt a folyamatot dehidrogénezésnek nevezzük. Reakció leírása: Megfigyelés: Reakcióegyenlet. A dehidrogénezés az alkohol oxidációját jelenti: -2 +2 0 +2 H 3 C- O - H + Cu O H - C HO + Cu + H 2 O Ez a reakció az alapja az aldehid névnek: dehidrogénezett alkohol, latinul: alcohol dehiyd rogenatus. (ii) Redukciójuk: Kajtár II. 111o Az aldehidek túlságosan könnyen redukálódnak, molekulájuk hidrogénatomok felvételével elsőrendű alkohollá alakulhat vissza. Ekkor a szénatom oxidációs száma 0-ról –2-re csökken, a felvett hidrogénatomé 0–ról +1-re nő. A redukciót többféle
módon is meg lehet valósítani: például hidrogénátvivő katalizátor (palládium, platina) jelenlétében hidrogéngázzal. +2H H–CHO CH 3 –OH aldehid elsőrendű alkohol C/13 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (iii) Oxidációja: Két fontos reakció: az ezüsttükör-próba v. Tollenspróba, illetve a Fehling-reakció Az ezüsttükör-próba: A leírás: Megfigyelés: A reakció: Figyeljük meg, hogy a reakcióban a szén oxidációs száma 0-ról +2re növekedett, tehát a karbonil csoport szénatomja oxidálódott, míg az ezüst ion redukálódott. Miért kell az ammónia oldat? Miért nem öntöttük hozzá közvetlenül az AgNO 3 - oldatot? Mert a reakció valójában egyensúlyi reakció, ahol sav képződik, és az ezüstnitrát oldat savas, s így visszafelé tolná el a reakciót. Miért pont ammónium-hidroxid-ot használunk? Mert az ezüst a lúgos közegben Ag 2 O-dá alakul,
amit az ammónia old fel ezüst komplex ionként. Ez a reakció az aldehidek kimutatására alkalmas, tehát minőségi analízisben is felhasználható. A reakciót használják fel a tükrök és a karácsonyfadíszek készítésénél! A Fehling-próba: szintén aldehidek kimutatására szolgál. A reakciót tanuljuk meg: A leírás: Megfigyelés: A reakció: Fehling I: rézszulfát oldat Fehling II.: NaOH + a borkősav Na és K sója: Natartarát. Szintén azért kell, hogy a keletkezett sötétkék Cu(OH) 2 csapadékot a borkősav sója oldatba vigye: Cu2+ és 2OH– alakban. (A közbenső sárga szín: CuOH, vagyis réz-I-hidroxid csapadék! 2 ilyenből lesz vízkilépéssel Cu 2 O A reakció az ezüsttükör próbához hasonlóan az aldehidre nézve oxidációs folyamat, melyben karbonsav keletkezik. C/14 2000/2001. 10 a-b Bp e) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Fontosabb aldehidek (i) metanal (formaldehid) Színtelen,
szúrós szagú gáz. Fp= –21°C Vízben jól oldódik Vizes oldata: Az oxovegyületek vizes oldatban részben vagy teljesen hidrátalakban, azaz mint geminális diolok fordulnak elő. Azonban ezek csakis vizes oldatban stabilak: Tehát reakciója a vízzel: Metán-diol keletkezik, ami azonban csak vizes oldatban stabilis. A keletkező formaldehid-hidrát állás közben – vízkihasadással – lassan fehér színű csapadékká polimerizálódik, melyben a monomerek száma 8–100: Sejtméreg, baktériumölő hatású, ezért fertőtlenítésre használják. Felhasználása: A gyakorlatban a 40%-os oldatát, a formalint használják: fertőtlenítésre. A húsok tartósításakor a füstöléskor a fenol mellett a másik konzerváló anyag! Az iparban műanyaggyártásra használják. (ii) etanal (acetaldehid) Jellegzetes szagú, alacsony Fp-ú (20°C) folyadék. Az acetilénből gyártják. Láttuk: (B/VII/2/d/ii) katalizátor (H 2 C=CH–OH) CH 3 –CHO HC≡CH+H 2 O
(vinil-alkohol) acetaldehid Az etanolból történő laborbeli előállítását láttuk. Rendkívül fontos alapanyaga a vegyiparnak: festékek, gyógyszerek, O műanyagok kiindulási alapanyaga. H2C C C (iii) 2-propenal (akrilaldehid) H A szagát mindenki ismeri: az odaégett zsír szagának szaganyaga.H A nevét is innen kapta: „acris” = szúrós (lat.) Valóban: a zsírok – ahogy azt látni fogjuk – glicerinszármazékok, s ha megfigyeljük az akril-aldehidet, észrevehetjük, hogy olyan, mintha a glicerinből kiszakadt volna két vízmolekula. (iv) benzaldehid: színtelen, keserűmandula szagú folyadék. Vízben nem oldódik Belőle állítják elő a fahéjaldehidet, (3-fenil-propénal) amit szappan-illatosításra, aromák, illatszerek előállítására használnak. H O C H C C O C/15 2000/2001. 10 a-b Bp 4) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Ketonok a) Definíció + elnevezés Def.: A ketonok azok az
oxovegyületek, melyekben a az oxocsoport láncközi szénatomhoz kapcsolódik. Funkciós csoportja a karbonil-, v ketocsoport. Általános jelölésük: R–CO–R’ Elnevezés: „szénhidrogén –№ –on” C 2 H 5 –CO– CH 3 C 2 H 5 –CO– C 2 H 5 CH 3 –CO– CH 3 propanon (aceton) butan-2-on pentan-3-on b) A funkciós csoport elektronszerkezete: láttuk c) Fizikai tulajdonságok (i) Op-Fp: A karbonilcsoport már megismert tulajdonsága miatt az éterek és az alkoholok között foglal helyet. De miért nagyobb az aldehideknél? Hasonlítsunk össze egy ketont és egy aldehidet: O CH3 C CH2 CH3 H C CH2 CH2 CH3 O d) Észrevehető, hogy míg a ketonban az oxocsoport olyan szénatomhoz kapcsolódik, melynek mindkét irányban van C atom szomszédja, addig az aldehidben a karbonilcsoportnak csak egy irányban van C szomszédja. Így a ketonban az oxocsoport jobban el tudja vonzani a karbonilcsoport szénatomjától a két kötő elektronpárt, hiszen a karbonilcsoport
jobbról-balról még tud magához vonzani elektront. Tehát nagyobb lesz a ketonban az oxigén parciális negatív töltése, mint az aldehidben, vagyis erősebb lesz a dipólus-dipólus kölcsönhatás. (ii) Oldhatóság: lsd. aldehidek: hidrogénkötés stb Kémiai tulajdonságok A ketonok kevésbé reakcióképesek, mint az aldehidek. (i) Előállításuk: a ketonok másodrendű alkoholokból, hidrogénelvonással, vagyis oxidációval hozhatóak létre. O H H3C C CH3 + CuO H O H3C C CH3 +H 2 O + Cu C/16 2000/2001. 10 a-b Bp e) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (ii) Nem redukáló tulajdonságúak, mint az aldehidek. A két aldehidet kimutató próbát ők nem adják. Csak nagyon erős oxidálószerekkel lehet oxidálni őket karbonsavvá. Ilyenkor felszakadnak, és karbonsavak keletkeznek. Ha egy R’–CO–R nem szimmetrikus ketont oxidálok így, akkor nem mindegy, hogy hol szakad el a kötés: R’–C v. C–R
között, mert más lesz a keletkező karbonsav! (iii) Redukciójuk: hidrogénatom felvételével másodrendű alkoholokká redukálhatóak: Fontosabb ketonok (i) Aceton (dimetil-keton, propan-2-on) A legegyszerűbb és legfontosabb keton. Kellemes illatú, alacsony Fp-ú (56°C), jellegzetes szagú folyadék. Vízzel és szerves folyadékokkal egyaránt korlátlanul elegyedik. Kitűnő oldószer! Festékek, lakkok oldásához használják. Dukkózás: Az acetonban oldott festéket sűrített levegővel rápermetezik a befestendő felületre, az aceton ezután gyorsan elpárolog, és a festék ott marad. Iparban az izopropil-alkoholból állítják elő. (ii) kámfor és H3C karvon (kömény és kaporban) lsd limonén! CH3 O H3C O 5) A tercier alkoholokból már nem dehidrogénezhetőek. C/17 2000/2001. 10 a-b Bp V. Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Karbonsavak 1) Definíciójuk és elnevezésük, csoportosításuk a) Def.
Karbonsavaknak hívjuk azokat a szerves vegyületeket, melyek molekuláiban a karboxilcsoport a jellemző funkciós csoport. A karboxilcsoport az azonos szénatomhoz kapcsolódó oxo- és hidroxilcsoportból felépülő összetett funkciós csoport. Egy karbonsavmolekulában csoportokat: különbözőképpen szénhidrogéncsoport – acilcsoport – karboxilcsoport hidroxilcsoport b) jelölhetünk ki savmaradék – hidrogénatom Elnevezésük: A szabályos elnevezésük az alapszénhidrogén (beleértve a karboxilcsoport szénatomját is) nevével és a sav szóval történik. Pl: C 2 H 5 –COOH H–COOH CH 3 –COOH metánsav etánsav propánsav hangyasav ecetsav propionsav A karbonsavak többsége már régóta ismert, főleg növényekből és állatokból izolálták őket. A triviális neveik általában annak a növénynek, állítnak stb. a nevéből adódnak, amelyekből kinyerték őket: hangyasav, almasav, citromsav stb. A többit majd a szisztematikus
tárgyalásnál nevezzük el. C/18 2000/2001. 10 a-b Bp c) 2) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Csoportosítás: • szénlánc szerint: telített, telítetlen, aromás, vagy egyéb funkciós csoportot tartalmazó szénlánc • a karboxilcsoportok száma szerint: egy-, kettő-, háromértékű karbonsav (mono-, di-, tri- előtag) A funkciós-csoport szerkezete (Pfeifer: 116.o) + Vált 4 el: 195-196-; A karboxilcsoport összetett funkciós csoport. Tulajdonságai eltérnek az őt alkotó két csoport tulajdonságaitól. A speciális szerkezet miatt az oxigénatom és a hidrogénatom közötti kötés erősen polarizálódik, következésképpen a hidrogénion már víz hatására is lehasad, tehát a karboxilcsoportot tartalmazó vegyületek vizes oldatai savas kémhatásúak. A kettős kötés π elektonpárját az oxocsoport-rész erősen maga felé húzza, emiatt a szénatom kevésbé engedi át az a másik oxigénatommal
létesített egyszeres kovalens kötés elektronpárját az oxigénatomnak, ami így kénytelen a hidrogénnel létrehozott σ kötést a szokottnál jobban polározni. A proton leszakadása után a karboxilátionban mindkét C–O kötés távolsága egyforma, ez azt jelenti, hogy a negatív töltés egyenletesen oszlik el a delokalizáló π-kötéssel együtt az egy síkba kifeszülő három atom alatt és fölött. C/19 2000/2001. 10 a-b Bp 3) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Fizikai tulajdonságok a) Op-Fp A karbonsav molekulák egymás között hidrogénkötést képesek kialakítani. Ez erősebb mint az alkoholok között, mert az O–H kötés erősebben polározott. A két karboxilcsoport között két erős hidrogénkötéssel összetartott gyűrű jön létre, így a részecskék dimerek alakjában vannak jelen. Ezért a forráspontjuk közelítően a kétszeres molekulatömegű szénhidrogénekével azonos, és az
alkoholokénál magasabb. b) Oldhatóság Már a szokott elvet lehet vizsgálni. Képes hidrogénkötést kialakítani a vízzel, ezért a kis apoláris résszel rendelkező savak jól oldódnak. Azonban mennél nagyobb az apoláris rész, annál kevésbé oldódnak. C/20 2000/2001. 10 a-b Bp 4) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Kémiai tulajdonság a) Előállításuk Többféleképpen lehet, és az iparban valóban többféleképpen állítanak is elő karbonsavakat. Itt az oxidációval történő előállítást vizsgáljuk: Aldehidből: Láttuk az aldehidek kimutatására alkalmas Tollens és Fehling próbát, amellyel egyben savat állítottunk elő. Felírtuk az aceton erélyes oxidációját cc. salétromsavval, amely során hangyasav és ecetsav keletkezett. b) Redukciójuk (Vált. 4 elemre: 346o) A karbonsavak – a széndioxidtól eltekintve – a szén legstabilabb oxidált származékai. Csak nagy
energia-befektetés árán, igen erélyes redukálószerrel lehet őket ebből a „mély energiaszintből” kimozdítani. De ilyen erélyes módszerrel viszont az átmenetileg keletkező aldehid sokkal gyorsabban és könnyebben redukálódik tovább, mint egy újabb karbonsav molekula. Így biztos, hogy a végállomás az alkohol redukció R–COOH erélyes R–CH 2 OH Az energiamodellen látható, hogy a meglökött golyó nem áll meg az aldehidnél, hanem legurul az alkohol szintjére. C/21 2000/2001. 10 a-b Bp c) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Savasságukra visszavezethető reakciók: (i) Vízzel A karbonsavak molekulái a vízmolekuláknak protont adhatnak át, ezért vizes oldatuk kémhatása savas. R–COO– + H 3 O+ R–COOH + H 2 O karboxilátion (ii) NaOH-dal: Vízben oldva az ecetsavnak csak kb. a 0,4 %-a disszociál, de ez ilyen erős lúg jelenlétében eltolódik! CH 3 COOH (l) + Na+
(l) +OH– (l) = CH 3 COO– (l) + Na+ (l) + H 2 O (iii) NaHCO 3 -tal. A NaHCO 3 . vizes oldatában hidrogén-karbonát-ionok vannak, (HCO 3 –) amelyek a savas természetű molekuláktól protont vesznek át, és így szénsavvá (H 2 CO 3 ) alakulnak át: A szénsav azonban bomlékony vegyület: H 2 CO 3 ⇔ H 2 O + CO 2 . A keletkező széndioxid pedig kipezseg az oldatból. Összegzés: Az ecetsav erősebb sav, mint a szénsav, ezért ezektől a hidrogén-karbonát ion átveszi a protont. (iv) Mg, Cu A hidrogénnél nagyobb redukálóképességű (kisebb standardpotenciálú) fémek az oxóniumionokat hidrogénfejlődés közben redukálják: 2 R–COO– + 2H 3 O+ + Mg = 2 R–COO–+Mg2+ + H 2 + 2H 2 O Rézzel azonban nem reagál! (v) pH táblázat: A savasságuk összehasonlítva más vegyületekkel: C/22 2000/2001. 10 a-b Bp d) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A savasság függése a molekulaszerkezettől. Híg oldatban:
K sav =[H 2 O]⋅(sav egyensúlyi állandója) Egy sav annál erősebb, mennél könnyebben le tudja adni a proton. (Igazából annál erősebb egy sav, mennél stabilabb a belőle proton lehasadásával keletkező anion.) Ha megfigyeljük a hangyasavat és a vajsavat, akkor a következőt állapíthatjuk meg: H H H O O H C C C C H C O H H H H O H A hangyasav hidroxilcsoportjának oxigénje egy olyan szénatomhoz kapcsolódik, amelyhez csak egy H és egy Oxocsoport kapcsolódik, míg a vajsavnál a Hidrogén helyett egy propilcsoport található. Ez utóbbinál tehát a szénláncon egy kicsit az karbonilcsoport szénatomja felé tud tolódni az elektronfelhő, így a hidroxilcsoport Oxigénje egy kevésbé elektronhiányos szénatomhoz kapcsolódik, mint a hangyasavnál. Így kevésbé polarizálódik az O–H kötés, vagyis nehezebben szakad le, mint a hangyasavnál. Kitalálható, hogy akkor hogyan lehet növelni egy karbonsav erősségét. A klórozott ecetsavnál
nézhetjük a disszociáció mértékét: H H C C H H O Cl O H 0,4% O O H klór-ecetsav 4% Cl Cl O Cl H C C C C H Cl O H diklór-ecetsav 20% O C C Cl O H triklór-ecetsav 40% A legerősebb halogén karbonsav a trifluor-ecetsav. Ennek 1 mólos vizes oldatában a molekulák gyakorlatilag 100%-ban disszociálva vannak, akárcsak a sósavban. Kitalálható, hogy egyéb szubsztituensekkel is erősíthetőek a karbonsavak. e) Észterképződés: később. C/23 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) VI. Fontosabb karbonsavak I: Alkánsavak (telített alkánokból levezethető savak): zsírsavak 1) Kis szénatomszámúak a) Hangyasav (Metánsav) (Lsd.: Pfeiffer: 116-117, 120 o (i) Általában O Nagyon csípős szagú és ízű, erősen maró hatású folyadék. A legegyszerűbb monokarbonsav A H C H vöröshangyák csípős váladékából vonták ki először, innen a neve. A hangyacsípéskor ez a sav
ingerli a szöveteket De más állatok, és növények (pl.: csalán) nedvében is megtalálható (ii) Fizikai tulajdonságok Fp: 101°C : a molekulatömeghez képest magas: hidrogénkötés! Oldhatóság: vízzel minden arányban elegyedik (iii) Kémiai tulajdonságai • Az egyszerű monokarbonsavak közül a legerősebb. • A hidrogénnél nagyobb redukálóképességű fémeket (Mg, Ca stb) hidrogénfejlődés közben oldja: 2 H–COOH + Mg = 2 H–COO– + Mg2+ + H2 Sói a formiátok: „magnézium-formiát” • Oxidációja: Az egyedüli karbonsav, mely egyben aldehid is, ezért az aldehidekhez hasonlóan redukáló tulajdonságú, oxidálható: Ezüsttükörpróba: O + – 2Ag + 2OH + 2Ag + CO 2 + 2H 2 O H C O H De a brómos vizet is elszínteleníti, vagyis a vízben oldott brómot bromid-ionná redukálja, miközben maga CO 2 -dá oxidálódik: H–COOH + Br 2 = CO 2 + 2Br– + 2H+ • Bomlása és előállítása Tömény kénsavval hevítve elbomlik: így
állítanak elő laborban szénmonoxidot: .H SO H–COOH cc CO + H 2 O Ha azonban tömény NaOH oldatba nagy nyomáson CO-ot sajtolnak, akkor nátrium-formiát keletkezik. Ebből a sóból aztán erős savval lehet felszabadítani a hangyasavat: atm;100 C NaOH + CO 10 HCOONa H SO HCOONa HCOOH (iv) Felhasználás Nagyobb mennyiségben a textil- és a bőriparban alkalmazzák. (Pl: bőrcserzésre) 2 4 o 2 4 C/24 2000/2001. 10 a-b Bp b) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Ecetsav (Etánsav) (i) Általában Szúrós szagú, színtelen folyadék. Természetes úton a borok levegővel történő érintkezése során képződik. A vízmentes ecetsav 17°C alatt kristályosodás következtében megszilárdul, ezért a tömény ecetsavat szokás jégecetnek is nevezni. (ii) Szerkezete: már láttuk. (iii) Fizikai tulajdonság Fp: 118°C : hidrogénkötés! Oldhatóság: vízzel minden
arányban elegyedik (iv) Kémiai tulajdonság • Savassága: A vízben való oldódása protolitikus, sav-bázis reakció: CH 3 –COO– + H 3 O+ CH 3 –COOH +H 2 O Az 1 mol/dm3 töménységű oldatban a molekuláknak csak a töredéke (kb. 0,4 %-a) adja le a protonját Így eléggé gyönge savnak számít: 0,004 mol dm 3 ⋅ 0,004 0,996 mol mol dm 3 ≈1,6⋅10–5 dm 3 • A hidrogénnél nagyobb redukálóképességű fémeket (Mg, Ca stb) hidrogénfejlődés közben oldja: 2 CH 3 –COOH + Mg = 2 CH 3 –COO– + Mg2+ + H 2 Sói az acetátok: „magnézium-acetát” • Előállítása: Étkezési célra: Az alkoholos oldatot olyan bükkfaforgácson csurgatják át, amelyre előzőleg ecetsvbaktériumokat telepítettek, és felfelé levegőt áramoltatnak. Először acetaldehid, majd abból ecetsav keletkezik: .: − 2 H ox.: +O CH 3 -CH 2 –OH ox CH 3 –CHO CH 3 – COOH Ilyen biológiai úton csak híg ecetsav állítható elő, mert az
ún. ecetgombák mind a tömény alkohol, mind a tömény ecetsav hatására elpusztulnak. Itt jegyzendő meg: alkohol fogyasztáskor is ez a folyamat játszódik le, majd a keletkező ecetsav a normális anyagcserében továbbalakul. A metil-alkohol viszont formaldehiddé alakul, amit azonban a szervezet nem tud tovább oxidálni: így a felhalmozódó sejtméreg súlyos károsodásokat okoz. Nagyipari előállítás. Acetilénből vízaddícióval, ahogy azt már láttuk. C/25 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (v) Felhasználás • A szervezetben az élő sejt anyagcseréjében van nagy szerepe: A táplálékkal felvett anyagokat (fehérjéket, szénhidrátokat, zsírokat) a sejt főként acetilcsoportokká alakítja. Az élő sejtben az ecetsav nem szabad állapotban, hanem egy bonyolult molekulához, a koenzim-A -hoz kapcsolódik:: ez az acetilkoenzim-A. O H3C C koenzim-A Az ecetsavat a sejt vagy
energiatermelésre használja fel, vagy a saját molekuláit építi fel belőle. c) 1975-ben az angol Cornforth kapott Nobel-díjat azért, mert felderítette, hogyan készít az élő sejt ecetsavrészekből koleszterin-molekulát. • Ételízesítés • Az iparban főleg gyógyszerek, festékek, műanyagok előállítására használják fel. Egyéb kis-szénatomszámú monokarbonsavak (i) propionsav: CH 3 –CH 2 –COOH A nátriumsóját élelmiszerekben és takarmányokban a penészedés meggátlására használják. (ii) A vajsav és a valeriánsav: C 3 H 7 –COOH és C 4 H 9 –COOH A vajsav glicerinhez kötve fordul elő a vajban, s annak avasodásakor szabadul fel. Ő és a valeriánsav minden egyes emberben más-más arányú keveréke adja azt a jellegzetes izzadságszagot, amelyet a kutya képes megkülönböztetni. C/26 2000/2001. 10 a-b Bp 2) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Nagy szénatomszámú
monokarbonsavak (Z.Orbán: 93o) a) Def. + Néhány fontosabb nagy szénatomszámú monokarbonsav Nagyszénatomszámú karbonsavaknak elnevezése önkényes, kb. a C 10 -C 20 -ig terjedő karbonsavakat. Pl.: COOH C 15 H 31 –COOH hexadekánsav = palmitinsav sói: palmitátok COOH C 17 H 35 –COOH oktadekánsav = sztearinsav sói: sztearátok 10 18 9 COOH C 17 H 33 –COOH cisz - 9 - oktadecénsav = olajsav sói: oleátok 12 13 18 10 9 COOH C 17 H 31 –COOH 9-cisz, 12-cisz-oktadekadienonsav= linolsav b) c) Megtalálhatóságuk: élő szervezetben kötött állapotban találhatóak meg. A palmitinsav és sztearinsav többnyire az állati zsírok, az olajsav a növényi olajok alkotórésze. Az olivaolaj csak olajsav-, a marhafaggyú pedig csak sztearinsavrészt tartalmaz. Növényekben több kettős kötést tartalmazó karbonsavak is előfordulnak kötött állapotban. Szerkezet Hosszú apoláris lánc végén található egy karboxilcsoport. Telítetteknél: a
konformáció miatt „tekereghet” Telítetlenek: a kettőskötés ott „síkbafeszít” és „megtöri” a szénláncot, így a másodrendű kapcsolatok nehezebben alakulnak ki. Fizikai tulajdonságaik. Op-Fp.: a telítettek szobahőmérsékleten kristályos vegyületek, a telítetlenek azonban ugyanilyen hőmérsékleten folyadékok. Op: sztearinsav: 90°C olajsav: 18°C linolsav: –5°C C/27 2000/2001. 10 a-b Bp d) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A telítetlen karbonsavak olvadáspontja alacsonyabb, mint az azonos szénatomszámú telítetteké, mert a kettős kötés „megtöri” a szénláncot, így a másodrendű kapcsolatok nehezebben tudnak kialakulni: Oldhatóság: A nagy szénatomszámú karbonsavak vízben nem, de apoláris oldószerekben jól oldódnak. A telítetlenek szénláncának telítése (i) Brómozás A telített szénláncú savak a brómos vizet nem színtelenítik el, de a telítetlen igen. Így
az olajsav addíciós reakcióba lép a brómmal: HC CH + Br 2 HC CH Br Br (ii) Hidrogénezés: lsd. később: Zsírok és olajok: olajkeményítés Katalizátor jelenlétében az olajsav a hidrogént is addicionálja. A reakciónak a növényi olajok „keményítésében” van szerepe. HC e) CH + H2 H2C CH2 Előállításuk: Az észter-típusú zsírok és olajok hidrolízisével állíthatóak elő. A reakciót lsd később A nevüket is innen kapták: palmitinsav: nevét a pálmazsírról, a sztearinsav: a görög „sztear”=faggyú, zsír szóból. Az olajsav a növényi olajokból állítható elő. C/28 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) VII. Fontosabb karbonsavak II (Vált 4 elemre: 314-) 1) Nem helyettesített egyértékű karbonsavak a) Alkánsavak: láttuk b) Telítetlen karbonsavak (Vált. 4: 330) (i) Olajsav O (ii) Linolsav H C C C (iii) Akrilsav: 2 H OH c) Aromás karbonsavak
(Vált. 4: 330) (i) Benzoesav: Az aromás gyűrűt tartalmazó karbonsavak közül a COOH legegyszerűbb. Fehér, kristályos anyag, vízben már gyengén oldódik. A trópusokon élő benzoefa izzadmánya benzoegyanta. Ennek a hevítésekor keletkezik egyebek közt a benzoesav. Belőle állították elő valamikor a benzolt (dekarboxilezéssel). Nátriumsója a nátrium-benzoát: az élelmiszeripar használja tartósítószerként. C 6 H 5 –COONa 2) Nem helyettesített dikarbonsavak, v. többértékű karbonsavak, (Vált 4: 331) a) Telítettek O O (i) Oxálsav (etándisav) C HO C OH Először is emlékezzünk: Ezt a reakciót Wöhler végezte el 1826 körül, s megdöntötte a visvitalis elméletet! A legegyszerűbb dikarbonsav. A sóskából vonták ki először, nevét a sóskafélék latin nevéről kapta: oxalis. Savassága: Két lépésben disszociál, az első disszociációban erősebb az ecetsavnál, de a másodikban már nem: logikus, a két karboxilcsoport erősen
elektronelszívó. Ha azonban az egyikről lehasadt egy proton, akkor az már inkább elektront küld, így a másik H már nehezen válik le! Sói: oxalátok: Savanyú káliumsója (HCOO–COOK) a vasionokkal vízben oldódó vegyületet képez, ezért ruhákból rozsdafoltok eltávolítására alkalmas. Vízben nem oldódó kálcium-oxalát képződik belőle, ha például kalciumion tartalmú vízzel keveredik. Ezért mérgező a szervezetre, hiszen vesekő kialakulását eredményezheti! C/29 2000/2001. 10 a-b Bp b) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (ii) Borostyánkősav (butándisav): (Acidum succinicum) A közönséges borostyánkősav a borostyánkőben COOH előfordul; innen a neve. A borostyánkő (succinit), ősvilági CH2 fenyőfáknak „ásatag” gyantája. rokon azzal a gyantával, CH 2 melyet a tűlevelű fák manapság is kiizzadnak. Az ősvilági fenyőfák gyantája a földbe kerülve, nagy idő multán kővé
COOH keményedett meg s ebben az alakban szerepel ma mint ásvány. Az élő szervezet anyagcsere-ciklusában van jelentősége. Telítetlen (i) A maleinsav és a fumársav: a két buténsav. O HOOC H H COOH H C C hevítés O - H2O HC C COOH H COOH H O maleinsav maleinsavanhidrid fumársav A Szent-Györgyi–Krebs - ciklus (más néven citromsavciklus = citrátciklus) fontos vegyülete. Szerepe a szervezet redox folyamataiban a borostyánkősavval együtt a hidrogénátvitelben van: E kettő sav mellé még néhány fontosabb, helyettesített savat fogunk megemlíteni a Szent-Györgyi – Krebs ciklusnál! (ii) Ftálsav: O COOH COOH hevítés - H2O C O C O ftálsav ftálsavanhidrid A ftálsavanhidrid az iparban az egyik legnagyobb mennyiségben előállított vegyület, főleg műanyagok gyártása céljából. C/30 2000/2001. 10 a-b Bp 3) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Helyettesített karbonsavak a)
Halogénkarbonsavak: már láttuk egy sorozatukat, + a trifluorecetsavat. b) Hidroxikarbonsavak (Vált. 4: 337) (i) Szalicilsav Nevét mindenütt ismerik, ahol nyáron otthon befőtteket tesznek el. Konzerválásra „szalicilt” szoktak használni. Lázcsillapító hatása van. Származéka az aszpirin, amit majd az észtereknél tanulunk Előállítása: O- Na+ OH OH nyomás COOH COONa erõs sav 120 C nátrium-fenolát nátrium-szalicilát szalicilsav (ii) Borkősav: (2,3-dihidroxi-butándisav): savanyú káliumsója a borkő, amely a hordók falára rakódik ki. A borkősavat, illetve sóit az élelmiszeriparban és a textiliparban használják fel. Sok fémionnal komplex sókat alkot. A sóit tartarátoknak hívjuk A Fehling-II reagens fontos összetevője! (iii) Tejsav (2-hidroxi-propánsav) HC CH COOH Szirupsűrű, vízzel elegyedő, színtelen, 3 OH kellemesen savanyú ízű folyadék. Az aludttejből fonható ki, ahol tejcukorból a tejsavbaktériumok hatására
keletkezik. A felhalmozódó tejsav miatt „megy össze” a tej A kazein nevű fehérje kicsapódik, aludttej, abból túró keletkezik. Hasonlóan erjedési folyamat eredménye a savanyúságban (pl. kovászos uborka) található, annak kellemes ízét adó tejsav. (iv) Citromsav (2-hidroxi-1,2,3-propántrisav) és almasav (hidroxiborostyánkősav) COOH COOH COOH COOH CH OH CH OH CH OH CH2 CH3 CH2 CH OH COOH COOH HO C COOH CH2 COOH tejsav almasav borkősav citromsav Az almasav és a citromsav a Szent-Györgyi - Krebs -ciklus fontos összetevői. A citromsav igen elterjedt növényi sav, mely a citromlében 5-7%nyi mennyiségben fordul elő. Ebben mutatta ki Scheele az 1700-as évek végén. Megtalálható az almában, körtében stb Ételízesítésre, textilszínezésre, vérkonzerválásra használják. C/31 2000/2001. 10 a-b Bp c) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Oxokarbonsavak (i) Oxálecetsav
(oxo-borostyánkősav): tagja a citromsavciklusnak. COOH C O CH2 COOH (ii) Piroszőlősav: a szénhidrátok és a fehérjék biológiai lebontásának és szintézisének egyik kulcsanyaga. A piroszőlősavból az élő sejtben különböző vegyületek képződhetnek: Az élesztőben található enzimek hatására a piroszőlősav dekarboxileződik, és acetaldehiddé alakul. Ebből redukcióval etil-alkohol képződik. Ez a szeszes erjedés A izmokban a piroszőlősav tejsavvá redukálódik. Ha ugyanis nagyon gyors erőkifejtésre van szükség (pl. futás), akkor a szervezet a véren át nem tud a az izmoknak elegendő oxigént juttatni ahhoz, hogy az ott felhalmozott szénhidrátot gyorsan szén-dioxiddá és vízzé égessék el, s így a kellő energiát fedezzék. Ilyenkor az izom a szénhidrátot levegő nélkül bontja le, de csak a tejsavig, s ebből az átalakításból fedezi a hirtelen szükséges energiát. Az izomban ez a képződő tejsav okozza az
izomlázat leggyakrabban azonban acetilcsoporttá és széndioxiddá oxidálódik. Az acetilcsoport C/32 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) VIII. Észterek 1) Def, elnev, csoportosítás (Kajt.II 88o) a) Definíció Észternek hívjuk azokat a szerves vegyületeket, O melyek molekuláiban az észtercsoport a jellemző funkciós csoport. Az észtercsoport az azonos R1 C O R2 szénatomhoz kapcsolódó oxo- és étercsoportból felépülő összetett funkciós csoport. b) Elnevezésük: Elnevezésüket csak akkor érthetjük meg könnyen, ha egy kicsit elővételezzük a keletkezésüket: A karbonsavészterek a karbonsavak és az alkoholokból származtathatjuk egy molekula víz kihasításával: Mivel a karbonsavészterek karbonsavak és alkoholok reakciójakor keletkeznek, ezért a nevük így származik. Egy észter ugyanis egy karbonsav és egy alkohol „éterének” tekinthető. Az ecet németül Essig,
így az „ecet-éter”, Es sig-äther rövidített alakja magyarosan az észter. A karbonsavból levezethető csoportok nevének ismeretében az észterek elnevezése könnyen megérthető: Az észtereket úgy nevezzük el, mint a karbonsavaknak olyan származékait, amelyekben a karboxilcsoport hidrogénatomját szénhidrogéncsoport helyettesíti. Így a nevük: alkil-alkanoát. (Vigyázat, igazából a két szénatom közti oxigén az alkoholból van!) Pl.: H C alkanoát csop. – alkilcsop alkil-alkanoát O alkánsav-alkil-észter H3C C O O CH3 metil-formiát hangyasav-metil-észter O C C2H5 etil-acetát ecetsav-etilészter O H3C C O c) O CH3 O metil-benzoát fenil-acetát benzoesav-metil-észter ecetsav-fenil-észter Csoportosítás: • A szervetlen (ásványi) savakból pedig a szervetlensav-észterek vezethetőek le. • A karbonsavakból levezethető észterek a karbonsavészterek Őket önkényesen egyszerű észterek; illetve „bonyolult savak és
bonyolult alkoholok” észterei csoportokra bonthatjuk. C/33 2000/2001. 10 a-b Bp 2) 3) 4) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A funkciós csoport szerkezete Az észtercsoport összetett funkciós csoport. Tulajdonságai eltérnek az őt alkotó két csoport tulajdonságaitól. Az észtercsoportban nincs hidrogén kötve oxigénhez, ezért hidrogénkötés nem tud kialakulni. Az oxocsoport oxigénje pedig nem olyan poláros, mint az ketonoké, sőt annyira sem, mint az aldehideké. Így kevésbé poláros a molekulának a funkciós csoportot tartalmazó részlete. Fizikai tulajdonságok a) Fp: alig nagyobb az étereknél, beszorul az éterek és aldehidek közé, hiszen csak gyengén poláros a funkciós csoport környékén a molekula. Az, hogy illatuk jól érezhető, éppen a könnyű párolgásuk miatt van! b) Oldhatóság: Az észterek eleve nem nagyon poláros vegyületek. A funkciós csoport hidrogénkötésnél csakis
akceptorként szerepelhet, ráadásul egy vízmolekula oxigénje polárosabb. Így a vízmolekulák hidrogénkötési rendszerébe nehezen épül be: már a legkisebb molekulatömegű észter, a metilformiát is csak korlátozottan elegyedik a vízzel. A nagyobb észterek pedig egyáltalán nem oldódnak vízben. Kémiája a) Előállítása általában Az észterképződés megfordítható, egyensúlyra vezető folyamat. Egy karbonsav és egy alkohol megfelelő egyensúlyig észterré és vízzé alakul, az észter pedig vízzel karbonsav és alkohol képződése közben hidrolizál. O O R1 + H O R2 C O b) H R1 + H2O C O R2 A reakciót egy nagyon kevés sav hozzáadásával lehet katalizálni. Vigyázat cc HCl-val is megy, vagyis ha cc. H 2 SO 4 -at használunk, akkor abból is elég néhány csepp, vagyis nem a kénsav „vízelvonó” hatása játszik szerepet, hanem a protonáló hatás. Ez a katalizálás mindkét irányban eredményes, vagyis nemcsak az
észterképződést segíti elő, hanem az észter hidrolízisét is. A sav katalizátor tehát „jól működik”: mindkét irányból gyorsítja az egyensúly beálltát, de egyik irányba sem tolja el a reakciót. Hogyan lehet valamelyik irányba eltolni a reakciót? Pl. feleslegben adagoljuk a kiindulási anyagot; vagy a terméket elvonjuk (észterképződésnél az észtert v. a vizet) Előállítása konkrét példán (i) Kísérlet: Figyelem: „kisózás” (ii) Megfigyelés Észterszag és két fázis jelenik meg. (iii) Reakció C/34 2000/2001. 10 a-b Bp c) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Észterek lúgos hidrolízise Mivel az észterképződés megfordítható folyamat, ezért ha az észtert víz feleslegben főzzük, akkor észterhidrolízis megy végbe. Ha a hidrolízist teljessé kívánjuk tenni, akkor a reakciót lúgos közegben kell végezni. Ez a folyamat már egyirányú, mert a az etilalkohol az
acetátionnal nem lép reakcióba. C2H5 O C CH3 + OH C2H5 OH + CH3 COO O 5) Az észterek lúgos hidrolízisét szokták szappanosításnak, „elszappanosításnak” nevezni, mert a zsíroknak mint észtereknek lúgos hidrolízisekor keletkező nagy szénatomszámú karbonsavak sói a szappanok. Észterek csoportjai a) Kis szénatomszámú észterek: Pfeiffer: 133. (i) Gyümölcsészterek Rövid szénláncú alkoholok és karbonsavak termékei. Többnyire kellemes illatú anyagok. A természetben mint a gyümölcsök aromaanyagai fordulnak elő. Mesterségesen is előállítják őket: likőraromát, oldószereket készítenek belőlük. (ii) Acetil–szalicilsav: Istopirin v. aspirin (Pfeiffer: 135; KajtII: 130) COOH b) c) COOH OH O + HO C CH3 O O C CH3 Láz és fájdalomcsillapító hatású. Ez így savas jellegű Kalciumsóját, a Kalmopyrint már a savra érzékenyek is szedhetik. Nagy szénatomszámú észterek: viaszok. A gyümölcsök héját vagy a bogarak
szárnyát bevonó, védő, finom viaszréteg szintén észtertípusú anyag. A méhviasz is ilyen: 80%-ban a palmitinsav és a miricil-alkohol (C 30 H 61 OH) észtere: miricil-palmitát: CH 3 –(CH 2 ) 14 –COO––CH 2 –(CH 2 ) 28 –CH 3 . Szervetlen savak észterei: az oxigéntartalmú szervetlen savak és alkoholok vegyületei. A legismertebb: a glicerin-trinitrát, vagy közismert nevén a nitroglicerin CH2 OH CH H O NO2 OH + H O NO2 CH2 OH H O NO2 NO2 cc. H2SO4 CH2 O CH O NO2 CH2 O NO2 Fojtott térben történő robbanása nagy feszítőerővel következi be, mert a nitroglicerin bomlástermékei gázok (a keletkező víz is gőzzé változik.) 2 C 3 H 5 (ONO 2 ) 3 6 CO 2 + 3N 2 +1/2O 2 + 5H 2 O C/35 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) IX. Zsírok és olajok 1) Definíciók: a) Gliceridek, trigliceridek: A glicerin észtereit glicerideknek nevezzük. Ezek közül azokat, amelyekben a
glicerin mindhárom hidroxilcsoportja acilezve van, triglicerideknek hívjuk (Furka 652:) b) Zsírok, olajok: A szilárd halmazállapotú, főleg sztearin- és palmitinsav-részletet tartalmazó, általában állati eredetű glicerideket nevezzük zsírnak, a folyékony, főleg linol- és olajsavval vannak acilezve, általában növényből származókat olajnak. (Pfeiffer: 135 + Kajtár 135:) c) Lipidek. A gliceridek a sejtekben levő egyéb vegyületekkel együtt (szteroidok, terpének, karotinoidok) főleg apoláris molekularészeket tartalmaznak, ezért vízben nem, csak ún. zsíroldószerekben (alkohol, éter stb) oldódnak Így az olyan sejtalkotó vegyületeket, amelyek vízben nem, csak zsíroldószerekben oldódnak, összefoglaló néven lipideknek nevezzük. (Kajtár 137; Pfeiffer 137) 2) Összetételük: (Z.Orbán: 97o) A glicerin három értékű alkohol, így három zsírsavmolekulával tud észtert képezni. A zsírsav lehet telített vagy telítetlen, de mindig páros
szénatomszámú karbonsav. A leggyakoribbak a palmitinsav, a sztearinsav, vagy az olajsavláncot tartalmazó gliceridek. O Pl. A glicerinnek a sztearinsavval, az olajsavval és a H2C O C C17H35 palmitinsavval adott észtere. O A zsírok szilárd halmazállapotú, többnyire állati eredetű HC O C C17H33 gliceridek. Molekulájuk főként palmitinsav-, illetve C sztearinsav részletet tartalmaz, vagyis telített savak H C O C C H 15 31 2 észterei. Az olajok folyékony halmazállapotú, főként növényi eredetű anyagok. Molekulájuk főleg telítetlen szénhidrogénláncot (olajsavrészlet) tartalmaz. Egy triglicerid-molekulában általában különböző karbonsav-részletek fordulnak elő, de van olyan triglicerid is, amelyben mindhárom acilező karbonsavrészlet azonos: Ilyen pl. a trisztearin (trisztearoil-glicerin) illetve a triolein (trioleoil-glicerin): Kajtár 135. O O H2C O C C17H33 O HC O C C17H33 C H2C O C C17H33 O HC O C C17H33 C H2C O C C17H33 H2C O C C17H33
trisztearin triolein C/36 2000/2001. 10 a-b Bp 3) 4) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Fizikai tulajdonságok a) Halmazállapot: A zsírok szilárdak, az olajok folyékonyak: adódik ez ugyanabból az okból, ami miatt a nagy szénatomszámú telített zsírsavak szilárdak (pl.: sztearinsav), a telítetlenek folyadékok (pl: olajsav) Vagyis a telítetlenek a bennük található „törés” miatt nehezebben rendeződnek egymás mellé, mint a telítettek, így nehezebben alakulnak ki a molekulák között a szilárd halmazállapotot biztosító másodrendű kapcsolatok. Ráadásul mivel a zsírok is, olajok is általában többféle gliceridekből állnak, ezért nincs pontos, meghatározott olvadási pontjuk, amorf anyagok. b) Oldhatóság: vízben, apoláris oldószerekben A gliceridek molekulái gyakorlatilag apolárisak, (a hosszú szénhidrogénlánc hatása), ezért vízben, poláros oldószerekben nem oldódnak. Apoláris
oldószerekben azonban (alkohol, benzol, éter) kitűnően oldódnak. Kémiai tulajdonságok: a) Katalitikus hidrogénezés Az olajokat hidrogénezéssel (katalizátor segítségével történő hidrogénaddíció) szilárd zsiradékká lehet átalakítani. Lsd VI/2/e/ii: telítetlen zsírsavak hidrogénaddíciója. Ez a folyamatot nevezik „olajkeményítésnek”. Így állítanak elő növényi olajokból margarint b) „Avasodás” Ismert káros tulajdonsága a zsíroknak és olajoknak, hogy a levegőn rövidebb-hosszabb idő alatt megavasodnak, amikor is csípős ízt és kellemetlen szagot kapnak. E változás alatt a zsírok kémhatása savanyúvá válik. Az avasodás nem minden zsírnál és olajnál következik be egyenlő mértékben és egyenlő idő alatt. Jórészben függ ez a zsír tisztaságától, a környezet nedvességétől, többé-kevésbé a hőmérséklettől és a fényhatásoktól. Az avasodás alkalmával a víz és az oxigén hatása alatt keletkező
zsírsavak, továbbá aldehid- és ketonszerű termékek okozzák a szagot. A világosságtól védett és száraz környezetben, lehetőleg sötétben tartott zsírok és olajok hosszabb ideig ellen tudnak állni az avasodásnak, főként, ha a levegőtől teljesen elzárható edényben tartjuk azokat. c) Szappanosítás: A trigliceridek lúggal (vizes NaOH oldattal) főzve glicerinre, és a megfelelő karbonsavak nátriumsóira hidrolizálnak. Az utóbbiak a szappanok. O CH2 C CH2 OH O R1 O CH C O R2 O R3 3Na+OH– víz OH CH2 OH O CH2 C R 1 –COO–Na+ R 2 –COO–Na+ + R 3 –COO–Na+ CH Zsírsav-Na-só „szappan” C/37 2000/2001. 10 a-b Bp d) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Polimerizálódás; A száradó olajok: A sok telítetlen kötést tartalmazó olajok – pl. a lenolaj, amelynek fő zsírsavkomponense a linolsav és a linolénsav – levegőn az oxigén hatására polimerizálódnak. A
különböző molekulák telítetlen láncai – általában a telítetlen kötés melletti szénatomokon át vagy az olefinkötésű részletek kapcsolódása útján – összekapcsolódnak egymással, s így térháló szerkezetű óriásmolekulák jönnek létre. Ez egy bonyolult folyamat, az olaj száradásának hívják. Az eddig ismertetett zsiradékokon kívül fontos szerepet játszanak még a gyakorlati életben a száradó olajok. Ezek jellegzetes képviselője a lenolaj, melyet lenmagvakból préseléssel, vagy kivonással nyernek. Lenolajon kívül száradók még a kender, mák, dió stb Nálunk a lakk-, kence-, mázoló- és linóleumipar elsősorban a lenolajat használja. Száradóknak nevezzük általában azokat az olajokat, amelyek a levegőn tartva megsűrűsödnek, száraz állományúak lesznek, tehát vékony rétegben fölkenve a felületen kemény rugalmas réteget (filmet) képeznek. A lenolaj összetételére olajsavból, linolsavból és linolénsavból
áll, mely savak, mint telítetlen vegyületek olyan tulajdonsággal bírnak, hogy a levegőből oxigént képesek fölvenni, azt megkötik, miközben megszilárdulnak „beszáradnak”. C/38 2000/2001. 10 a-b Bp X. Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) Szappanok és mosószerek 1) Def.: A nagy szénatomszámú karbonsavak nátrium- vagy káliumsói a szappanok. 2) Szerkezetük: Mivel a szappanok a nagyszénatomszámú karbonsavak sói, ezért vízben oldva ionjaikra disszociálnak. A anion hosszú szénlánca apoláris, a vízmolekulákat taszítja, a negatív töltésű karboxilát-ion rész viszont a vízmolekulákat vonzza. Az apoláros részt hidrofóbnak (víztaszító gr.), a poláris részt hidrofilnek (vizet kedvelő gr.) nevezzük 3) Fizikai tulajdonságok: csak a felületaktív tulajdonságának vizsgálatakor nézzük. 4) Kémiájuk a) Előllítás (Pfeiffer 138.) Már az ókoriak tudták, hogy zsírok és alkáliák
(szóda=sziksó=Na 2 CO 3 , „lúgkő”=NaOH) együttes főzésekor olyan anyag keletkezik, amely növeli a víz tisztítóhatását. Ezeket az anyagokat szappannak nevezték A 12 századtól Európa-szerte elterjedt, háziiparrá fejlődött a szappangyártás. Ma már szinte kizárólag vegyi üzemekben készülnek a legváltozatosabb minőségű szappanok. Az iparban a szappangyártás során a zsírok hidrolízisét magas hőmérsékletű vízgőzzel és katalizátorral végzik: O CH2 C O C17H35 O C17H35+ 3H 2 O O C17H35 O CH C CH2 OH Kat. Hõ CH OH+3C 17 H 35 COOH CH2 OH O CH2 C trisztearin + vízgőz glicerin sztearinsav A keletkezett zsírsavakat elválasztják a glicerintől, majd nátrium-karbonáttal (szódával) szappanná alakítják: 2 C 17 H 35 COOH + Na 2 CO 3 = 2 C 17 H 35 COONa + H 2 CO 3 Az így nyert szappanhoz lágyító- és illatosító anyagokat adnak, majd formába öntik. A zsírsavak nátriumsói (nátronszappan) kemény szappanok, a
káliumsói viszont lágyak, ilyen a kenőszappan (káliszappan). b) Kémhatásuk: A szappanok gyenge savak sói, ezért vízben részben hidrolizálnak, oldatuk lúgos kémhatásúak: C 17 H 35 COO– + Na+ + H 2 O ⇔ C 17 H 35 COO H + Na+ + OH– Emiatt sajnos károsítják a bőrt illetve kemény vízben, melynek sok a Ca2+ és Mg2+ tartalma, csapadékot képeznek: Ca(C 17 H 35 COO) 2 . Így hatásuk csökken. C/39 2000/2001. 10 a-b Bp 5) Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) A szappanok és mosószerek tisztító hatása a) Def.: Felületi feszültség: Az az energia, amelyet akkor kell befektetnünk, amikor egy folyadék felületét egységnyi felülettel növeljük. Jele: α Mértékegysége: J/m2 N/m „Képzeljük el, hogy egy végtelen finom csipesszel benyúlunk a folyadék belsejébe, és onnan kiemelünk egy molekulát. Ismételjük meg ezt a műveletet egy olyan molekulával, amelyik a folyadékcsepp felszínén foglal
helyet. Ez a felületi molekula nincs minden oldalról szomszédokkal körülvéve, csupán alatta vannak folyadékmolekulák. Ezért kevesebb munkát kell végeznünk akkor, ha ezt a felületi molekulát akarjuk a megegyezésünk szerinti <zérushelyre> vinni.” Gamow: 272 b) Felületaktív anyagok (i) Oldódásuk, majd elhelyezkedésük a vízben. Kevés szappan oldódásakor a nagy apoláros résszel rendelkező molekulák előbb utóbb „kitaszítódnak” a víz felületére, s „imbolygó bójákként” emelkednek ki a számukra kényelmetlen környezetből a levegőbe. „Horgonyuk” a negatív töltésű részletük, amely a vízben jól oldódik. Ha már elég sok anion van egymás mellett, akkor azok apoláris felükkel vonzzák egymást, s egymással párhuzamosan és a felületre merőlegesen helyezkednek el. Már így csökken a víz felületi feszültsége, hiszen gyakorlatilag nincsenek vízmolekulák a felületen. Töményebb szappanoldatban a szappan
részecskéi, ionjai a hosszú hidrofób résszel a vízmolekulák közé furakodva megbontják a vízmolekulák közti hidrogénkötéseket, ezért így is csökkentik a felületi feszültséget. (A felületi feszültséget csökkentő hatás lesz a felületaktív anyag fő jellemzője!) Ui.: könnyebb most már a folyadék felületére kivinni a belül elhelyezkedő molekulát, hiszen az nem köt olyan erősen, vagyis csökkent a felület növeléséhez befektetendő energia. (ii) Micellák: Ráadásul a töményebb szappan-oldatban, amelyben az összes oldott részecske már nem fér el a víz felületén, a víz belsejében kénytelenek „úszkálni”, amíg össze nem terelődnek. Ekkor úgy helyezkednek el, hogy az apoláris részüket befelé tartva diszperziós kötéssel kapcsolódnak egymáshoz, és a poláros részüket kifelé tartva a vízzel dipólusdipólus kötést létrehozva gömbökbe, vagy ha már többen vannak, lemezkékbe rendeződnek, melyek a gömböknél
nagyobb felületűek. Def.: A folyadék belsejében létrejött halmazokat (asszociátumokat) micelláknak nevezzük. C/40 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) (iii) A habképződés: Ha töményebb szappanoldatot jól összerázunk, akkor dús hab képződik a felületén. Mi ennek az oka? A zsírsavsó- és vízmolekulákból álló rendszer számára az az állapot a legkedvezőbb, ha a zsírsavsó molekulái a víz felületén helyezkednek el. Csakhogy a víz térfogatához képest a felülete nagyon kicsi. Ezt növeli meg a hab A zsírsavsó molekulái kilökődnek a hab felületére, s a vékony vízhártyákat kívül-belül monomolekulás réteg borítja be, ami stabilizálja a felületet, a habot. A szappanbuborék fala így folyékony kristálynak tekinthető. Mechanikailag ui a folyadékokhoz hasonló, hiszen láthatóan folyik, a benne elhelyezkedő anionok viszont – a szilárd kristályokhoz
hasonlóan – hosszútávú rendezettséget mutatnak. Érdekesség, hogy a felületi feszültség miatt a hártyák a minimálfelületre törekszenek, ugyanakkor a felületaktív anyag számára a nagy felület a kényelmes! c) (iv) Def: Felületaktív anyagok.: Az olyan anyagokat, amelyek monomolekuláris rétegek kialakítása útján a folyadékoknak - habképzés révén megnövelt felületét stabilizálni képesek, felületaktív anyagoknak nevezzük. A tisztítás mechanizmusa Ezek után vizsgáljuk meg, hogy tisztítanak a szappanok, illetve más felületaktív mosószerek! A ruhaneműkhöz a viselés során zsír tapad, s ebben a por, a korom, a szennyeződés könnyen megtapad. A tiszta víz erről lepereg. Ha azonban felületaktív anyaggal együtt mossuk, akkor a felületaktív anyag molekuláinak az apoláris része – ahogy a víz felületéből is kilóg – a zsírba, mint számára kedvező apoláris közegbe, belefúródik úgy, hogy az ionos része a vízben
marad. A zsírfolt fellazul, s mindenhol körbeveszik ezek a molekulák. Így már egy nagy micella jelenik meg a vízben, amely kifelé poláros, belül egy zsírfolt van, s ez már nem tapad vissza a ruhára. Természetesen mozgatni kell a mosás közben a ruhát, egyébként ez az oldatbavitel nagyon lassú lesz! C/41 2000/2001. 10 a-b Bp Szerves kém. Z Orbán Erzsébet Kémia IVA szerves kémiáról (2000, 42 oldal) XI. A szerves vegyületek szaga: Kajt: Vált 4 elem: 295o) XII. A konfigurációs izoméria 1) Ism. Lsd B/V/6: térizoméria v sztereoizoméria 2) A szőlősav felfedezése (Balázs: 541) + Pasteur + saját füzet vége fele: rajzzal! 3) A konfiguráció: Kajtár Vált. 4 elemre: 429 o teteje 4) A konfigurációs izoméria: Kajtár II. 160 5) Kiralitás: Kajtár: II. 161-162 6) Több kiralitás centrum: Kajtár: II. 163-164 C/42




