A doksi online olvasásához kérlek jelentkezz be!
A doksi online olvasásához kérlek jelentkezz be!
Nincs még értékelés. Legyél Te az első!
Mit olvastak a többiek, ha ezzel végeztek?
Tartalmi kivonat
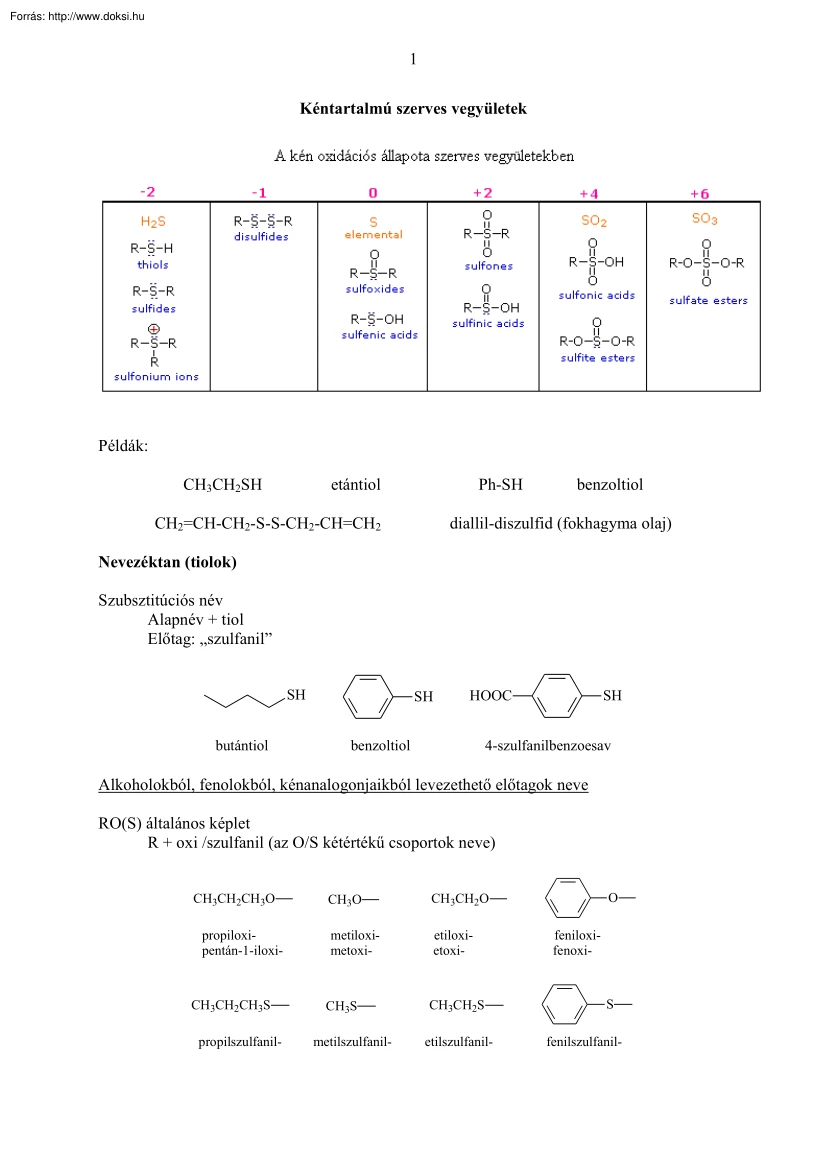
1 Kéntartalmú szerves vegyületek Példák: CH3CH2SH etántiol Ph-SH CH2=CH-CH2-S-S-CH2-CH=CH2 benzoltiol diallil-diszulfid (fokhagyma olaj) Nevezéktan (tiolok) Szubsztitúciós név Alapnév + tiol Előtag: „szulfanil” SH butántiol SH HOOC benzoltiol SH 4-szulfanilbenzoesav Alkoholokból, fenolokból, kénanalogonjaikból levezethető előtagok neve RO(S) általános képlet R + oxi /szulfanil (az O/S kétértékű csoportok neve) O CH3CH2CH3O CH3O CH3CH2O propiloxipentán-1-iloxi- metiloximetoxi- etiloxietoxi- CH3S CH3CH2S S etilszulfanil- fenilszulfanil- CH3CH2CH3S propilszulfanil- metilszulfanil- feniloxifenoxi- 2 Sók anion neve + az ol utótagot „olát”-ra cseréljük b.) ha az RO csoportnak rövidített neve van (pl metoxi), az anion nevét „oxid” utótaggal is képezhetjük CH3O-Na+ CH3CH2S-Na+ a.) nátrium-metanolát b.) nátrium-metoxid nátrium-etántiolát nátrium-etil-szulfid Éterek és szulfidok elnevezése Általános
képlet: ROR’, illetve RSR’ a.) Szubsztitúciós név: R’O, R’S előtag + RH alapvegyület b.) Csoportfunkciós név: betűrendben, kötőjellel elválasztva az R, R’ csoport neve + kötőjel + éter/szulfid funkciós csoportnév O(S) O(S) a.) 1-propoxi(propilszulfanil)pentán b.) propil-pentil-éter(szulfid) O(S) Cl 1-etoxi(etilszulfanil)-2-klóretán etil-(2-klóretil)-éter(szulfid) etoxi(etils zulfanil)etén etil-vinil-éter(szulfid) Ciklusos éterek a.) heterociklusos vegyületként b.) epoxi mint elváló előtag, + alapnév c.) alapnév + oxid funkciós csoportnév 2 O O 3 a.) oxirán b.) c.) etilén-oxid 2 3 O 7 4 1 2-etil-2-metiloxirán 1,2-epoxi-2-metilbután 1 5 6 7oxabiciklo[4.10]heptán epoxiciklohexán ciklohexén-oxid Kötésrendszer A C–S kötés apoláros, mivel a szén- és kénatom elektronegativitása azonos (2,5). A kénatom elektonegativitása kisebb, mint az oxigénatomé (3,5) és a kén központi atommagtöltését két
lezárt elektronhéj is árnyékolja (O: 1s2, 2s22p4; S: 1s2, 2s22p6, 3s23p4), s így az atommag pozitív töltésének a viszonylag távoli vegyértékhéjra gyakorolt hatása csekély mértékű. 3 Az éterek és tioéterek kötésszögében is eltérés mutatkozik, azonos szubsztituensek esetén a kénvegyületekben a kötésszögek jóval kisebbek. Fizikai tulajdonságok A kénatom nagyobb méretű és könnyebben polarizálható, mint az oxigén, ezért az S– H kötés gyengébb, mint az O–H kötés. Ebből következik, hogy a tiolok nemcsak az alkoholoknál, hanem a víznél is erősebb savak, így már vizes lúggal is sót képeznek. kén-hidrogén (pKa=7,04) HS H + H2O HS + H3O tiolok (pKa=8) RS H + H2O RS + H3O CH3 CH2 CH2 SH + KOH propán-1-tiol CH3 CH2 CH2 SK + H2O kálium-propán-1-tiolát káliumprop-1-il-szulfid A fentiekkel függ össze, hogy az alkiltiolát-anion gyengébb bázis, ugyanakkor erősebb nukleofil, mint az alkoxidion. A gyengébb
S–H kötéssel kapcsolatos a tiolok nagyfokú érzékenysége oxidálószerekkel szemben. Már a levegő oxigénjének vagy más enyhe oxidálószernek (pl. I2 vagy K3[Fe(CN)6]) a jelenléte diszulfidokhoz vezet A reakció megfordítható, így redukálószerek (pl. Zn + HCl) hatására visszanyerhető a tiol 4 Erélyes oxidálószerek (pl. persavak, KMnO4 stb) hatására a tiolok szulfonsavvá alakíthatók A szulfonsavak vízben oldódó erős savak, az aromás származékokat bőrcserző anyagként használják. Tiolok előállítása Alkil-halogenidekből Na- vagy K-hidrogénszulfiddal, alkalmazni, a további alkilezések elkerülése végett. amit feleslegben kell Tiokarbamidból S-alkilezéssel, majd lúgos hidrolízissel (ebben az esetben nem képződnek melléktermékek): Reakciók 5 Fontosabb tiolok Etántiol: színtelen, nagy higításban is kellemetlen szagú folyadék. Forráspontja 35 °C Vízben rosszul, alkoholban jól oldódik. Világszerte
egyezményesen az eredetileg teljesen szagtalan földgáz szagosítására használják. A szaga mindenkinek gyakorlatilag egyet jelent a gáz jelenlétének feltételezésével, ami igen hasznos figyelmeztetés, lévén a fölgáz az ember számára máshogy nem lenne érzékelhető. A szag-inger már jóval a robbanásveszélyes koncentráció kialakulása előtt kellemetlenné és figyelemfelkeltővé erősödik, ezáltal megelőzhetővé téve egy esetleges katasztrófát. Szulfonsavszármazékok Jelentősek a szulfonsav-kloridok (ld. alkánok, benzol reakciói), melyek sok irányba alakíthatók át. A szulfonamidok fontos gyógyszerek (Ultraszeptil, Szulfaguanidin) 6 R N H2N SO2 HN N R' Szulfaguanidin (R, R' = H, Me) Szuperszeptil (R,R' = Me) SO2Cl SO2NHR H 2O RNH2 szulfonamid ROH H2 /kat. SH tiol SO2OH szulfonsav SO2OR szulfonsav-észter A benzolszulfonil-klorid átalakításának lehetőségei: A toluol klórszulfonálásával nyerhető
szulfonsavszármazékok mesterséges édesítőszerek (szacharin) ill. fertőtlenítőszerek (Diklóramin-T) 7 2 mol ClSO3H SO2Cl NH3 SO2NH2 SO2NH2 NH3 ox. SO2Cl SO2NH2 NaOCl OH O SO2NCl2 S O O S NaOH N Na Diklóramin-T O - H2O O NH O O szacharin-Na só (oldódik vízben) szacharin Nitrovegyületek Nitrovegyületek levezetése: O HO HO N N O O salétromsav salétromossav O R N O R O nitrovegyület (nitroalkán) Nitrocsoport szerkezete: O R N N O R O N O O salétromsav-észter (alkil-nitrát) nitrozovegyület (nitrozoalkán) salétromossav-észter (alkil-nitrit) 8 Elnevezés Csak szubsztitúciós nomenklatúra Nitro-, nitrozo előtag + alapvegyület O2N NO CH3NO2 nitrometán nitrozobenzol Előállítás: NO2 NO2 1,3-dinitrobenzol (preferált) o-dinitrobenzol 2-nitronaftalin Alifás vegyületek: lásd alkánok Aromás vegyületek: elektrofil szubsztitúcióval 1. NO2 NO2 HNO3 H2SO4 60 °C füstölgő HNO3 H2SO4 100 °C
NO2 NO2BF4 NO2 FSO2OH O2N NO2 2. A trinitrotoluol (más néven trotil vagy TNT) gyakran használt robbanóanyag. A toluol nitrálásával állítható elő (ld. fent) Fizikai tulajdonságok A nitrovegyületek forráspontja és olvadáspontja – a nitrocsoport jelentős dipólus momentuma következtében kialakuló erős dipól-dipól kölcsönhatásai miatt – jóval magasabb a megfelelő szénhidrogénekéhez és azok más monoszubsztituált származékaihoz képest. A nitroparaffinok színtelen, jellegzetes illatú, általában bomlás nélkül desztillálható vegyületek. Vízben alig, vagy egyáltalán nem oldódnak, viszont lúgban oldódnak és többnyire szerves oldószerekkel is jól elegyednek. A mononitro-származékok általában színtelenek, a több nitrocsoportot tartalmazó származékok sárga színűek. 9 Az aromás nitrovegyületek többsége szobahőmérsékleten szilárd, kristályos anyag – kivétel a nitrobenzol, mely folyadék, forráspontja 207
C. A nitrocsoportok számával az olvadáspont általában nő. Vízben alig, tömény salétromsavban és számos szerves oldószerben viszont jól oldódnak. Nitro-acinitro tautoméria: a nitro csoporttal szomszédos C-H kötés lazított, a nitro csoport erősen elektronszívó. Redukció Az alifás és aromás nitrovegyületek hasonló reakciókat szenvednek. A redukció esetén azonban különbözően viselkednek, aszerint, hogy alifás vagy aromás szénlánc kapcsolódik a nitro csoporthoz. Általános redukciós folyamat: A termék szerkezete a redukáló ágens, valamint a közeg pH-jától függ. Katalitikus hidrogénezés Redukció fémek jelenlétében, savas közegben: Fe, Sn, Zn / HCl (Béchamp redukció) 10 Redukció semleges közegben: Zn por / ammónium-kloriddal, hidroxil-amin keletkezik A hidroxil-aminok ammóniás ezüst-nitráttal (Tollens reagens) melegítve, nitrozoszármazékokká alakulnak, és ezüsttükörré redukálják a Tollens reagenst
(BakerMulliken teszt, a nitrovegyületek kimutatására). Redukció bázikus közegben A redukáló ágenstől függően a nitrobenzol különböző termékekké alakul. 11 Redukció LiAlH4-el Az alifás nitrovegyületek primer aminokká alakulnak. Az aromás nitrovegyületek azoszármazékokat adnak. Trinitrotoluol A nagy tisztaságú TNT halványsárga színű, levegőn lassan barnuló, kristályos vegyület. Vízben gyakorlatilag nem oldódik, azonban szerves oldószerek (aceton, metilén-klorid, toluol) kiválóan oldják. A TNT kitűnő, igen alacsony ütésérzékenységű, közepes hatóerejű kémiai robbanóanyag. Még az első világháború alatt terjedt el és akkora népszerűségre tett szert, hogy ezt az anyagot választották mind a kémiai, mind a nukleáris robbanás erejének viszonyítási alapjául. Előállítás Toxicitás és környezeti ártalmak A TNT erősen mérgező vegyület. Bőrrel való érintkezéskor sárgás elszíneződés és erős
irritáció léphet fel. A második világháború alatt, azok a hadianyag munkások, akik érintkezésbe kerültek vele és besárgult tőle a bőrük, a "kanári" gúnynevet kapták. Hosszú idejű expozíció esetén vérszegénység, elégtelen májfunkció, lép megnagyobbodás és egyéb immunrendszeri károk alakulnak ki. Továbbá tény, hogy a férfiaknál hátrányosan befolyásolja a nemzőképességet, és, mint lehetséges rákkeltő van nyilvántartva. A trotil elfogyasztásakor a vizelet piros árnyalatúvá válik, amit annak metabolitjai okoznak, és nem vér, mint azt korábban hitték. Némely katonai gyakorló területeken a felső talajréteg kimutathatóan szennyeződött trotillal. A talajvíz ennek köszönhetően pedig rózsaszínűvé vált Az utólagos mentesítés drága és komplikált művelet. Alkalmazásai 12 A TNT az egyik legnagyobb mennyiségben alkalmazott ipari és katonai robbanóanyag. Óriási előnye az igen alacsony ütés- és
dörzsérzékenysége, ami jelentősen csökkenti alkalmazásának kockázatát. Kristályai 80 °C-on megolvadnak, ezzel könnyen töltényezhető, formába önthető és keverhető egyéb robbanóanyagokkal. Bomlása és spontán detonációja csak jóval e hőmérséklet felett következik be. A TNT nem higroszkópos és nem is oldódik vízben, ezért ebből a szempontból gond nélkül tárolható nedves környezetben. Stabilitása is kiváló a többi brizáns robbanóanyaggal való összehasonlításban. Robbanása mértékét a képződő gázok nagy feszítő ereje okozza (H, N, CO2). Dinamit és TNT Közkeletű tévedés, hogy a dinamit és a TNT egy és ugyanaz. Valójában, amíg a TNT egy önálló kémiai vegyület, addig a dinamit egy keverék, amely többnyire nitroglicerinből és flegmatizátorból (leginkább kovaföldből) áll. Aminok Természetes vegyületek 13 Foltos bürök kávécserje dohány Conium maculatum Coffea arabica Nicotiana tabacum Mák
Légyölő galóca Nadragulya Papaver somniferum Amanita muscaria Atropa belladonna Elnevezés RNH2, RR’NH, RR’R”N típusú vegyületek Primer aminok a.) RH alapvegyület + amin (főcsoportot jelölő utótag), (szubsztitúciós művelet) b.) R-csoport + kötőjel + amin funkciós csoportnév (csoportfunkciós nomenklatúra) 4 NH2 5 3 O 4 NH2 2 benzofurán-2-amin (benzofurán-2-il)-amin 3 N 4 2 2 N 1 a.) propánamin b.) propil-amin NH2 3 1 1 kinolin-3-amin (kinolin-3-il)-amin HOOC 4-aminobenzoesav Szekunder és tercier aminok NH2 2 1 5 imidazol-4-metánamin (imidazol-4-ilmetil)-amin Ha az NH2- nem főcsoport, akkor „amino” előtagként használjuk: HO NH NH2 3 4 NH2 3-aminobutanol 14 Szimmetrikus aminok: R2NH, R3N b.) „di” vagy „tri” + csoport neve + kötőjel + amin funkciós csoportnév NH (CH3CH2)3N (ClCH2CH2)2NH difenil-amin trietil-amin bisz(2-klóretil)-amin Aszimmetrikus aminok: RR’NH, R2NR’, RNR’R” a.) az
alap primer amin N-szubsztituált származéka b.) R, R’, R” csoportok (megfelelő sokszorozó taggal ellátva, egymástól kötőjellel elválasztva, betűrendbe sorolva) + kötőjel +amin funkciós csoportnév Cl NH N N C6H5 a.) N-(2-klóretil)propán-1-amin b.) (2-klóretil)-propil-amin N-etil-N-metilbután-1-amin butil-etil-metil-amin N-etil-N-propilanilin etil-fenil-propil-amin Kötésrendszer Az aminok szerkezetét a nitrogénatom sp3 hibridizációjának megfelelő trigonális piramisos geometria jellemzi, az N–C vegyértékszögek értéke pedig közelítőleg 108. Az ammóniából vezethetők le, a hidrogén atomok szénláncra való cseréjével. 15 Fizikai sajátságok Az aminoknak (akárcsak az alkoholoknak) sokkal magasabb a forráspontjuk, mint a hasonló molekulatömegű szénhidrogéneknek. A kis szénatomszámú aminok poláris jellegükből adódóan egymással dipol–dipol kölcsönhatásba lépnek, illetőleg hidrogénkötéseket képeznek.
Ezek – a szénhidrogénekre nem jellemző – intermolekuláris kölcsönhatások okozzák a szénhidrogénektől jelentősen eltérő fizikai tulajdonságokat. Az intermolekuláris hidrogénhíd kötődések az aminokban gyengébbek, mint az alkoholokban. (nitrogén kisebb méretű, a vegyérték elektronok és a nemkötő pár nagyobb magvonzás alatt állnak). R1 R1 N H R2 N H amin R H O H R2 O R alkohol Az alacsonyabb szénatomszámú aminok vízben jól oldódnak (jobban, mint az alkoholok és az éterek, mert a nitrogénatom jobb protonakceptor, mint az oxigén), a nagyobb szénatomszámúak (pl. az aromás aminok) esetében a szénhidrogén-maradékok hidrofób jellege kerül túlsúlyba és ezért az oldhatósága romlik. Az aminok szerves oldószerekben jól oldódnak. A kvaterner ammónium vegyületek és a különböző rendű aminok ammóniumsói ionos szerkezetük révén vízben általában jól, szerves oldószerekben kevésbé vagy egyáltalán nem
oldódnak. Az aminok kellemetlen szagú vegyületek (pl a bomló hal szaga származik aminokból). A szagra való utalás sok esetben az amin nevében is tükröződik A bután-1,4diamin triviális neve: putreszcin (putresco: megrothad), a bután-1,5-diamin triviális neve: kadaverin (cadaver: hulla). Az aminok bázicitása Gázfázisban szolvatáció hiányában a bázicitást a szubsztituensek elektronos hatása határozza meg. Elektronküldő csoportok növelik a nitrogénatom elektronsűrűségét és így a bázicitást is Bázicitás növekvő sorrendje gázfázisban: (CH3)3N > (CH3)2NH > CH3NH2 > NH3 Oldat fázisban – így vízben is – mindezen túl a dipol–dipol kölcsönhatás és hidrogénkötés hatása is érvényesül. 16 H H3C N dipól-dipól kölcsönhatás H HO H H X H3C N H X H hidrogénkötés H H O H Vizes közegben az alkilcsoportnak kettős hatása van az ammóniumionra. Egyrészt elektronküldő sajátsága révén
elősegíti a töltésdiszpergálódást, s így az iont stabilizálja, másrészt nehezíti az oldószermolekula hozzáférését, azaz a szolvatációt. E két hatás eredője alakítja ki az adott amin bázicitását. Az ammóniumion egyetlen hidrogénjének metilcsoportra történő cseréje közelítőleg egy egész egységgel növeli a bázicitást. A második hidrogénnek a cseréjekor azonban a bázicitás már nem változik, mivel a stabilizáló és destabilizáló hatás kiegyenlíti egymást. A harmadik hidrogénatom cseréje után viszont – a szolvatáció csökkenése miatt – a destabilizáló hatás kerül túlsúlyba. Így a legerősebb bázisok a szekunder aminok. Bázicitás növekvő sorrendje vízben: Az anilin kisebb bázicitásának oka: a nitrogén nemkötő elektronpárjának az aromás rendszerrel való konjugációs kölcsönhatása. Ezt elektronszívó szubsztituensek még jobban csökkentik. Kémiai tulajdonságok Alkilezés: vegyes termékek, nem
kedvező módszer, elválasztást igényel. 17 Mechanizmus: Acilezés: védőcsoport, savkloridok, savanhidridek, szulfonsav-kloridok alkalmazásával Hinsberg próba: aminok elválasztása, rendűség alapján. 18 Aminok reakciója salétromossavval Primer aminok Szekunder aminok A nitrozoaminok erősen mérgező, rákkeltő vegyületek! Tercier aminok Aromás primer aminok Aromás szekunder aminok Aromás tercier aminok 19 Reakció oxovegyületekkel Leválasztásra használható: a primer aminok imineket képeznek Mechanizmus: A szekunder aminok enaminokká alakulnak. Mechanizmus: Eliminációs reakciók A kvaterner ammónium-sók ezüst-oxid jelenlétében, melegítés hatására eliminációs reakcióba lépnek, és alkének keletkeznek. (Hofmann elimináció) 20 Mechanizmus: Szelektivitás Ismeretes, hogy az E2 reakciók sztereokémiai feltétele a H-C kötés és C-LG kötés antiperiplanáris állása (180o). Ez a konformáció biztosítja a
felhasadó kötések megfelelő helyzetét a kötés kialakulásához. Az előző ammónium-só lehetséges konformációi és energia viszonyaik: 21 A konformerek energiatartalmából látható, hogy csak a láncvégi alkén képződése kedvező. A Hofmann szabály szerint a hidrogén a kevésbé szubsztituált szénatomról lép ki. Diazóniumsók átalakításai: Sandmeyer reakció, Gatterman reakció (réz-sók jelenlétében), NaBF4-dal Schiemann reakció. 22 Azokapcsolási reakciók Diazovegyületek Általános képlet: R2C=N2 Az elektron szerkezetük a következő rezonancia formákkal írható le: A legstabiabb származékok az α-diazoketonok és α-diazoészterek, mert ezek esetében a negative töltés megoszlik a karbonil csoporton. A legtöbb diazovegyület heves robbanószer 23 Kereskedelmileg is hozzáférhető vegyület az etil-diazoacetát (N2CHCOOEt). Hasonló tulajdonságúak a gyűrűs származékok, a diazirinek. Diazometán: metilezőszer,
semleges közegben (gáz, fp. -23ºC, éterben nyeletve használják) Azovegyületek felhasználása Az aromás azovegyületeket a textiliparban színezékként, az analitikai kémiában pedig savbázis indikátorként alkalmazzák. A vegyületek színe molekuláik -elektronrendszerének könnyű gerjeszthetőségével függ össze, azaz már a látható fény is gerjeszteni tudja a HOMO pályán levő elektronjaikat. Az azocsoport protonálódásával azonban megváltozik a gerjesztési energia, ezáltal a protonált és nemprotonált formák színe is különbözik. Ezen a jelenségen alapul indikátor szerepük. O O S O CH3 N N N O S CH3 O CH3 N N N CH3 O sárga (lúgban) pH > 4,0 max = 454 nm +H O O S O H N N -H O CH3 O S N CH3 metilnarancs O H N N CH3 N CH3 piros (savban) pH < 3,1 max = 504 nm A metilnarancs indikátor színváltozása természetesen független a szulfonsav protonáltsági fokától. Azt csak az azocsoport – mint
kromoforcsoport – nitrogénjének protonálódása, illetve deprotonálódása határozza meg. Aminok előállítása Primer aminok: 24 Szekunder és tercier aminok: 25 Aldehidek és ketonok Természetes vegyületek Fahéj Cinnamonum verum Citromfű Cymbopogon marginatus Szibériai pézsmaszarvas Moschus moschiferus vanilia Vanilla planifolia Konyhai kömény Carum carvi Kámforfa Cinnamomum camphora 26 Kötésrendszer, szerkezet A karbonilcsoport, C=O Formaldehid C: 1s22s22px12py1 Oxigén: 1s22s22px22py12pz1. Kötési energia A kötési energia értékéből az adódik, hogy a kettős kötés kialakulása egyes reakcióknál hajtóerő lehet, mivel energetikailag kedvező. A C=O kettős kötés kötési energiája nagyobb mind a C-O egyszeres kötés energiájának kétszerese. 27 Polaritás Tekintettel a töltésszétválásra, a nukleofil addíciók jellemzők. Aldehidek nevezéktana Általános képlet: C C O H a.) ha a megfelelő karbonsavnak
triviális neve van, a sav latin szótöve + aldehid b.) aciklusos mono és dialdehidek: azonos szén atomszámú szénhidrogén neve + al, dial c.) más aldehidek: alapnév + karbaldehid utótag Előtag: „formil” CH3CHO 3 4 CHO OHC CHO 2 a.) acetaldehid b.) etanal c.) OHC 1 3 pentanal 2 1 CHO pentándial OHC 3 CHO b.) c.) bután-1,2,4-trikarbaldehid 2 CHO ciklohexánkarbaldehid 1 CHO CHO 2-(formilmetil)hexándial Ketonok nevezéktana Általános képlet: C C C O a.) szubsztitúciós név: alapnév + „on”, „dion”, stb utótag előtag: „oxo” b.) csoportfunkciós név (mono- és vicinális diketonok esetében): R,R’ csoportnevek betűrendben, kötőjellel elválasztva, + kötőjel + keton/diketon utótag 28 O O a.) bután-2-on b.) etil-metil-keton heptán-2-on metil-pentil-keton O O O O 1-fenilpentán-2,3-dion benzil-etil-diketon COOH O a.) heptán-2,4-dion 4-oxociklohexánkarbonsav N H O piridin-2(H)-on Aromás ketonok
esetében: „ofenon”, „onafton” utótag is használható O O a.) 1-feniletanon b.) fenil-metil-keton acetofenon difenilmetanon difenilketon benzofenon O 1-fenilpropanon etil-fenil-keton propiofenon O 1-naftiletanon metil-naftil-keton acetonafton Aldehidek és ketonok fizikai tulajdonságai A legegyszerűbb oxovegyület a formaldehid gáz-halmazállapotú, de a legtöbb aldehid és keton jellegzetes illatú folyadék. Forráspontjuk a karbonilcsoport polározottsága miatt kialakuló dipol–dipol kölcsönhatásoknak köszönhetően magasabb, mint az azonos móltömegű szénhidrogéneké, de alacsonyabb, mint az alkoholoké. A kisebb szénatomszámú vegyületek vízben korlátlanul oldódnak, a szénlánc növekedésével az oldékonyság csökken. Szerves oldószerekben általában jól oldódnak. Kémiai tulajdonságok Nukleofil addíciós reakciók: a karbonil szénen 29 Reakció az -helyzetű szénen: a proton lazított, tekintettel a karbonil csoport
elektronszívó tulajdonságára A reaktivitást befolyásoló tényezők: Reverzibilis reakciók Reakció oxigén-nukleofilekkel Kivétel: klorál (Neve a klór és az aldehid szavak összevonásából ered). A három klóratom elektronszívó hatása miatt, a víz könnyen addícionálódik. 30 Fizikai és kémiai tulajdonságok Színtelen, szúrós szagú folyadék. Sűrűsége 1,51 g/cm3 Olvadáspontja -57,5°C Forráspontja 97,8°C Vízzel reakcióba lépve klorál-hidrát keletkezik Előállítás Etanol klórozásával Felhasználás A klorál-hidrát nyugtató hatású, régen nyugtatószernek alkalmazták. A DDT gyártásának egyik kiindulóanyaga volt. Acetálképzés aldehidekből: védőcsoport 31 Reakció nitrogén-nukleofilekkel imin (Schiff bázis) Mechanizmus: Enaminok: Mechanizmus: Néhány, leválasztásra alkalmas reakció: 32 Reakció szén-nukleofilekkel Hidrogén-cianid addíció Ireverzibilis reakciók Az oxovegyületek redukciója
Katalitikus hidrogénezés 33 Redukció fémhidridekkel: lítium-alumínium-hidrid, nátrium-tetrahidrido-borát Mechanizmus: Az oxovegyületek oxidációja Krómsavval: szekunder alkoholok esetén, ketonok képződnek, a primer alkoholok karbonsavvá oxidálódnak. Piridinium-kloro-kromáttal: primer alkoholok esetén, aldehidekké. 34 Oxidációs lehetőségek: Mechanizmus: Reakció fémorganikus vegyületekkel Laboratóriumban gyakran alkalmazott módszer alkoholok előállítására. Mechanizmus: 35 Enol-oxo tautoméria Szerkezeti izoméria: egy proton és egy kettős kötés vándorlása Sav katalízis: Bázis katalízis: 36 Az oxovegyületek-szénatomján lejátszódó reakciók Előzményük: a keto-enol tautoméria -Hidrogén savassága: pKa = 19 pKa = 17 A ketonokban több alkil csoport van, amelyek elektronküldő tulajdonságúak, ezért a keton enolátja kevésbé stabil. Enolátok reakciói: Michael addíció: 37 Mechanizmus:
Haloform reakció Halogénezés: sav- vagy bázis katalízis alatt megy végbe Mechanizmus: sav katalízis 38 Bázis katalízis: Aldol reakció Bázis katalízis Sav katalízis: 39 Az aldolok dehidratálhatók, ,-telítetlen aldehidekké. Oxovegyületek kimutatási reakciói Az aldehidek kimutathatók ezüsttükör (ammoniás ezüst-oxid – Tollens)- vagy Fehling-próbával (réz-szulfát + Na,K-tartarát + NaOH oldat) Tollens teszt 40 Fehling teszt Karbonsavak Szerkezet A delokalizáció (stabilabb rendszer) miatt a karbonsavak mért energia tartalma 24 kcal/mól értékkel kisebb, mind a számított érték (konjugációs vagy stabilizációs energia). A delokalizáció léttrejöttét bizonyítja a kötéstávolságok értéke is. A karboxilcsoportban a karbonilcsoport kötéshossza nagyobb, mint mint az aldehidekben, a C-O kötés azonban rövidebb, mint az alkoholokban. A határszerkezetekből látszik, hogy az elektron delokalizáció nem teljes, a
karbonil oxigénen nagyobb az elektron sűrűség, az O-H kötésben levő elektronok az oxigén atomtörzshöz 41 húzódnak, ezért a proton lehasadása könnyen bekövetkezhet. Ezért a karbonsavak erősebb savak, mint pl. az alkoholok, ahol a konjugáció nem következhet be A karboxilát anion: stabil, szimmetrikus delokalizációju, képződése hajtóerő. Elnevezés Aciklusos mono és dikarbonsavak: szénhidrogén neve + sav, disav utótag COOH hexánsav HOOC COOH hexándisav COOH hex-4-énsav 42 Ha több karboxilcsoport kapcsolódik közvetlenül a nem elágazó lánchoz: szénhidrogén neve + kötőjel + sokszorozó előtaggal karbonsav utótag COOH HOOC COOH bután-1,2,4-trikarbonsav Ha gyűrűs az alapvegyület: alapnév + karbonsav utótag COOH ciklohexánkarbonsav Előtag: „karboxi” COOH N COOH Cl HOOC COOH CH3 (3-karboxi-1-metilpiridinium)-klorid 3-(karboximetil)heptándisav Karbonsavak sói Kation neve + kötőjel + alapnév + oát (sav
utótag helyett „oát” = anion) COO K (CH3COO - )2Ca2+ K OOC káluim-butanoát kalcium-diacetát kálium-nátrium-szukcinát COO Na Karbonsavak nevének eredete Néva Származásb Megjegyzés Adipinsav L, adeps, zsír Telítetlen zsírok oxidációjakor keletkezik. Almasav Először éretlen almából állították elő. Benzoesav Egy Indonéziában honos fa gyantájából, a benzoegyantából állították elő. Borkõsav Borkészítéskor "borkő" alakjában válik ki (a borkõ, latinul tartarus, kálium-hidrogén-tartarát). Borostyánkõsav A borostyán desztillációs bontásakor képzödő 43 desztillátumban fedezték fel. Ecetsav Fumársav Az ecetben található. L, fumus, füst A Fumaria nevű növényben található; a növényt régen azért égették, hogy a füstjével elűzzék a gonosz szellemeket. Hangyasav Hangyák desztillációs bontásával állították elő. Glutársav Először a glutaminsavból állították elő.
Kapronsav L, caper, kecse Kecsketejben található, szaga a kecskére emlékeztet. Linolsav, lenolajsav G, linon, len + olaj Glicerin-észter formájában megtalálható a lenolajban. Maleinsav L, malum, alma Az almasav dehidratációs terméke. Malonsav L, malum, alma Először az almasav oxidációjával állították elő. Oxálsav G, oxisz, savanyú Savanyú ízű vegyület, az Oxalis nemzetséghez tartozó növényekből vonható ki. Palmintisav L, palma, pálma Megtalálható a pálmaolaj gilcerin-észterében. Piroszõlõsav G, piro, tûz A (szőlőből kiváló) borkősav pirolízisével állítható elő. Propionsav G, proto, elsõ és pion, zsír A legrövidebb szénláncú sav, amely a hosszabb zsírsavak tulajdonságait mutatja. Sztearinsav G, sztear, faggyú Növényi és állati zsírok glicerin-észtereiben fordul elő. Tejsav Aludttejben fedezték fel. Vajsav Avas vajban található. Valeriánsav, macsakgyökérolaj A Valeriana officialis
(macskagyökér) gyökeréből nyerik ki. (A macskákra ingerlően hat a növény fő alkaloidja.) a G: görög, L: latin Fizikai tulajdonságok a forráspont magasabb, mint a megfelelő alkoholokké, ok: dimer képződés, hidrogénkötések révén. 44 Vízoldhatóság: Kémiai tulajdonságok: átalakítási lehetőségek A karbonsavak savi jellege: Szubsztituált karbonsavak savi erőssége: 45 A karbonsavak dekarboxilezése: Szerkezettől függ: elektronszívó csoportok kedveznek a folyamatnak Mechanizmus: Dikarbonsavak hevítése: hosszabb lánc esetén anhidridek képződnek 46 Karbonsavak reakciói Karbonsavak átalakítása savkloridokká: különböző reagensekkel lehetséges, de nem hidrogén halogenidekkel. Fontos, mert az összes többi karbonsavszármazék előállítható savkloridokból Mechanizmus: nukleofil szubsztitúció 47 Észterképzés savkatalízis, egyensúly reakció 48 semleges közegben, diazometánnal A
karbonsavak halogénezése -helyzetben: Hell-Volhard-Zelinsky reakció Mechanizmus: 49 Az -halogénezett savak reakciókészsége Karbonsavak kimutatási reakciói pH mérés: 5% ecetsav oldat, pH papír Nátrium-bikarbonát teszt CO2 fejlődés pozitív teszt Zsírsavak A kémiában zsírsavaknak hívjuk azokat a (mono)karbonsavakat, melyek hosszabb (legalább 8 – egyes kémikusok szerint 4 – szénatom hosszúságú), telített vagy telítetlen alifás láncot tartalmaznak. A természetben előforduló zsírsavak általában páros számú szénatomból épülnek föl, ugyanis a bioszintézisük a 2 szénatomos acetát-csoportokból (ecetsav) történik. A zsírok és zsírszerű anyagok (olajok) annyira elterjedtek a növényvilágban, hogyha csekély mennyiségben is, de majdnem minden növényi alkatrészben feltalálhatók. A növények egyes részei és pedig leggyakrabban a magvak, súlyuknak mintegy felét kitevô magas zsírtartalommal bírhatnak. Az
állatvilágban a növényvilághoz hasonlóan szintén igen elterjedtek az olaj- és zsírféleségek. Sokszor vastag rétegekben, laza sejtek közé ágyazva, vagy bôr alá rétegezve, mint "szalonna", a hasüregben, mint "háj", a szárcsontokban és koponyaüregben, mint "velô" vannak felhalmozva. Egyes rovarok, pl a méhek testükbôl nagy mennyiségû zsírt (viaszt) választanak ki. A tengerekben élô állatok, nevezetesen a bálnák és rozmárfajták teste különösen zsírdús. Az előfordulásnak megfelelôen a növényi zsíroknál a magokat és a terméseket, míg az állatoknál a zsírszöveteket, melyek a zsírt magukba foglalják (szalonna, háj, csontzsír, velô), dolgozzák fel zsírkinyerés céljaira. A zsírsavak a glicerinnel triglicerideket alkotva képezik a természetes zsírokat és olajokat. 50 A zsírsavak redukciójával kaphatjuk a zsíraldehideket illetve a zsíralkoholokat. Telített Képlet Triviális név
Olvadáspont CH3(CH2)10CO2H laurinsav 45 ºC CH3(CH2)12CO2H mirisztinsab 55 ºC CH3(CH2)14CO2H palmitinsav 63 ºC CH3(CH2)16CO2H sztearinsav 69 ºC CH3(CH2)18CO2H arachidinsav 76 ºC Telítetlen Képlet Triviális név Olvadáspont CH3(CH2)5CH=CH(CH2)7CO2H palmitoleinsav 0 ºC CH3(CH2)7CH=CH(CH2)7CO2H olajsav 13 ºC CH3(CH2)4CH=CHCH2CH=CH(CH2)7CO2H linolsav -5 ºC CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7CO2H linoleinsav -11 ºC CH3(CH2)4(CH=CHCH2)4(CH2)2CO2H arachidonsav -49 ºC A zsírok és olajok fôalkatrészei közül a keményebb zsírokban (pl. disznózsírban és még inkább a faggyúban) inkább a sztearinsavas és palmitinsavas glicerinészter, a folyékony zsírokban – vagyis olajokban – fôként az olajsavas glicerinészter dominál. Étkezésre szolgáló olajok és zsírok kinyerése és elôkészítése természetesen különös eljárásokat, gondos munkálatokat igényel, mert ezeknek az olajoknak a higiénia követelményeinek is
eleget kell tenni. Itt említjük meg, hogy a legáltalánosabban használt étolaj a hideg, vagy csak a gyengén melegpréselésű olivaolaj, melynek savmentesnek és szagtalannak kell lenni. Étolajul azonban jól felhasználható a szezámolaj, nemkülönben a tökmagolaj, a napraforgóolaj és a kendermagolaj is. 51 A mesterséges ételzsírok közül külföldön nagy szerepet játszik a művaj vagy más néven margarin. Margarin gyártására marhafaggyút szokás használni, melyből sajtolással mindenekelőtt oleomargarint készítenek. Oleomargarin alatt a faggyúnak 30–32 Co között még folyékony részét értjük. A présből kifolyó oleomargarin megdermedés után fehér, legfeljebb gyengén sárgás tömeget alkot, mi ételek készítésére közvetlenül is felhasználható. Hogy ebből vajszerű tömeget nyerjünk, még további eljárásnak kell alávetni, melyet vajasításnak neveznek. Ez lényegileg abban áll, hogy az oleomargarint tejjel dolgozzák el,
miközben a vajszerű állomány biztosítására más zsírokat (szezámolajat, kókuszolajat, gyapotmagolajat stb.) is adnak hozzá Jó minőségű margarinvaj pl a következő anyagokból készül: Nyári készítmény Téli készítmény Teljes tej 500 l 500 l Oleomargarin 500 kg 500 kg Faggyú 25 kg – Szezámolaj 50 kg 70 kg Dán vajfesték 0,40 kg 0,40 kg A zsírok és olajok technikai feldolgozásának legősibb módja az, hogy belőlük szappant főzünk. A képződő nátronszappan nem egyéb, mint a zsírokban foglalt zsírsavak nátriumsójának keveréke. Az egyidejüleg felszabaduló glicerin a házi szappanfőzésnél veszendőbe megy. Szappanok és detergensek 52 A felületaktív anyagok mosóhatása A tenzidek vízben oldható anyagok. A homogén elegy (oldat) kialakulásának előfeltétele a mosásnak (mosogatásnak, mosdásnak), ami nem más, mint a szennyeződések eltávolítása a tisztítandó felületről felületaktív anyag
tartalmú készítmény és sok víz segítségével. A tenzideknek e folyamatban kifejtett tevékenységét nevezzük mosóhatásnak. Ez többféle, egyidejűleg lejátszódó részfolyamat eredményeképpen valósul meg. Elsőként a felületaktív anyagok közrefogják a szennyeződést (és a mosandó textíliát), azaz nedvesítenek. Erősebb kapcsolatot képesek létesíteni a szennyeződéssel és a textíliával, mint a szennyeződés a textíliával, ezért e két anyag közé is beékelődnek. A szennyeződést így lefejtik és kisebb molekulahalmazokra bontják, aprítják, idegen szóval: diszpergálják. Ez a részfolyamat annál gyorsabban zajlik le, minél nagyobb felületen terül el ugyanaz a szennyeződésmennyiség, valamint minél frissebben került az a textíliára. A felületaktív anyagok diszpergáló hatása A rászáradt, régi, erősen kötődő, nagy mennyiségű szennyeződés fellazítása csak hosszas áztatás során valósítható meg. A
fellazított, leválasztott, szétdarabolt folyékony szennyeződés kis gömböcskék alakjába húzódik össze, amiket természetesen körülvesznek a felületaktív anyag molekulái és az e körül lévő vízmolekulák, a hidrátburok. A szilárd szennyeződést hasonló módon darabolja, leválasztja és eltávolítja a textil szálaitól. Ez a kettős gyűrű biztosítja a szennyeződés tökéletes emulgeálását. Az emulgeáló hatás (azaz a kettős elektromos burok) gátolja meg azt, hogy a szennyeződés újra visszatapadhasson a mosólében lévő textilneműre. 53 A felületaktív anyagok emulgeáló hatása a) a szennyeződés eloszlatása; b) a szennyeződés visszajutásának megakadályozása Viaszok spermaceti méhviasz karnauba viasz CH3(CH2)14CO2-(CH2)15CH3 CH3(CH2)24CO2-(CH2)29CH3 CH3(CH2)30CO2-(CH2)33CH3 Ámbrás cet (Physeter macrocephalus) prunifera) Házi méh (Apis mellifica L.) Carnauba pálma (Copernicia A nagy molekulasúlyú zsírsavaknak
nagy molekulasúlyú egyértékű alkoholokkal képezett észterei a viaszok, melyek szagtalan szilárd anyagok, s külsőleg a paraffinra emlékeztetnek. Kémiailag azonban lényegesen különböznek a paraffinektől, mert elszappanosíthatók, vagyis vízfelvétellel savra és alkoholra bonthatók fel, míg a paraffinek szénhidrogének lévén, nem bomlanak. A viaszok állati és növényi szervezetek anyagcseretermékeiként fordulnak elő a természetben, kisebb-nagyobb mértékben más anyagokkal (pl. szénhidrogénekkel, szabad savakkal) szennyezve. A legközönségesebb viasz a méhviasz, mely főtömegében a palmitinsavnak miricilalkohollal képezett észteréből, C15H31COOC30H61, áll. Természetes állapotában sárga színű, 63–65 Coon olvadó viasz, mely gyakran fehérített állapotban kerül forgalomba (sárga és fehér viasz) Különböző ipari célokra, s az orvosi gyakorlatban kenőcsök alapanyagául használják. A bőrgyógyászatban előszeretettel
használják a bálnaviaszt vagy cetaceumot (spermacet-et), mely a bálna-félék koponyaüregében található. Ez az 50 Co-on olvadó kristálylemezkékből 54 álló viasz főleg a palmitinsav cetilalkohollal képezett észteréből, C15H31COOC16H33, áll. A kínai viasz rovaroknak az anyagcsereterméke és cerotinsavas cerilészterbôl áll, C25H51COOC26H53. Az állati eredetű viaszok közül említésre méltó még a gyapjúzsír (lanolin), mely a gyapjún keletkezik és a gyógyszerészetben, valamint a kozmetikában játszik fontos szerepet. A carnauba-viasz viszont, melyet pl. paraffingyertyák fehérítésére használnak, növényi eredetű és fő alkotórésze a cerotinsavas miricilészter, C25H51COOC30H61. Karbonsavszármazékok Levezetés, általános képlet Kémiai rokonság Származékok Savhalogenidek: 55 a.) csoportfunkciós név: acilcsoport + kötőjel +halogenidek neve betűrendben b.) funkciós csoport módosítását jelző név: sav neve +
kötőjel + halogenid neve O Br Br Cl H3C Cl O O a.) acetil-klorid b.) ecetsav-klorid O hexanoil-bromid hexánsav-bromid Cl O malonil-bromid-klorid malonsav-bromid-klorid Előtag: „halogénkarbonil” O Cl tereftaloil-diklorid tereftálsav-diklorid O O Cl OH O Cl O O klórkarbonilecetsav etil-[2-(klórkarbonil)benzoát] Anhidridek Szimmetrikus anhidridek: sav neve + kötőjel + anhidrid funkciós csoportnév O O O O O O ecetsav-anhidrid Gyűrűs anhidridek: O O hexánsav-anhidrid O ciklohexánkarbonsav-anhidrid a.) szimmetrikus anhidridként b.) heterociklusként O O O O a.) borostyánkõsav-anhidrid (butándisav-anhidrid) b.) tetrahidrofurán-2,5-dion O O O O glutársavanhidrid pentándisav-anhidrid tetrahidropirán-2,6-dion O ftálsav-anhidrid 1,3-dihidroizobenzofurán-1,3-dion Aszimmetrikus (vegyes) anhidridek: a két sav betűrendben, kötőjellel elválasztva + kötőjel + anhidrid 56 O O O O O O butánsav-propánsav-anhidrid O O Cl O
ecetsav-klórecetsav-anhidrid benzoesav-propánsav-anhidrid Előtag: „aciloxikarbonil” H3C O O CH2 O OH O acetiloxikarbonilecetsav Észterek Alkil és/vagy aril csoportnév betűrendben felsorolva + kötőjel + anion neve C O H5C 2OOC COOC2H5 O etil-butanoát dietil-hexándioát H5C2OOC etil-metil-malonát O C COOCH3 OC2H5 etil-ciklohexánkarboxilát Gyűrűs észterek: laktonok Amidok a.) sav nevében a „sav” vagy „karbonsav” utótagot „amid” utótagra cseréljük b.) triviális nevű karbonsav esetén: acilcsoport szótöve + amid 57 c.) sav neve + kötőjel + amid (funkciós csoport módosítását jelző név) Előtag: „karbamoil” (CONH2 csoport) a H2NCOOH szerkezetű karbamidsavból O O CH3 C NH2 NH2 a.) etánamid b.) acetamid c.) ecetsav-amid O NH2 pentánamid ciklohexánkarboxamid pentánsav-amid ciklohexánkarbonsav-amid COOH CONH2 2-karbamoilbenzoesav N-szubsztituált amidok: RCONHR’, RCONR’R”: mint nitrogénen
R’, R” csoporttal helyettesített származékok O O NH CH3 b.) N-metilbenzamid O NH N-fenilbenzamid benzanilid CH3 C NH N-fenilacetamid acetanilid Gyűrűs amidok: laktámok Nitrilek Más néven cianidok (pszeudohalogenidek) Általános képlet: R C N a.) Szubsztitúciós név: (savszármazékként) szénhidrogén neve + nitril, dinitril, karbonitril b.) Triviális nevű karbonsavakból levetetett nitrilek: acilcsoport szótöve + „onitril” c.) Csoportfunkciós név: R előtag neve + kötőjel + cianid 58 C N CH3C N a.) etánnitril b.) acetonitril c.) metil-cianid pentánnitril valeronitril butil-cianid NC butándinitril szukcinonitril CN CN CN ciklohexánkarbonitril ciklohexil-cianid benzolnitril benzonitril fenil-cianid Előtag: ciano CN COOH CN 4-cianopentánsav NC NC CN 3-(cianometil)hexándinitril Kémiai tulajdonságok Szubsztitúció karbonil szénatomon Reaktivitás, illetve egymásba való átalakíthatóság: CONH2 CN
2,4-dicianobenzamid 59 60 Reakciótípusok Észterek savas hidrolízise Észterek lúgos hidrolízise Gliceridek hidrolizíse: ld. előbb szappanok is 61 -Dikarbonilvegyületek Szerves vegyületek savassága: Stabil szerkezet kialakulása miatt, az egyensúly eltolódik az enol felé Enolát forma stabilizációja: 62 Claisen kondenzáció Dieckmann kondenzáció Acetecetészter szintézisek 63 Malonészter szintézisek Dekarboxilezés mechanizmusa: Szénsavszármazékok Néhány átalakítás: Részletesebben lásd a Novák-Nyitrai könyvet. Láncban szubsztituált karbonsavak (halogén, hidroxi) szintén. 64 AMINOSAVAK Aminosavak csoportosítása és nevezéktana Az aminosavak olyan karbonsavszármazékok, amelyekben a szénhidrogéncsoportok egy vagy több hidrogénjét aminocsoport helyettesíti. Az aminosavakat a szénhidrogénrész jellege (alifás/aromás), valamint az aminocsoportnak a karboxilcsoporthoz viszonyított helyzete szerint
osztályozzuk, és így megkülönböztethetünk -, -, - stb. aminosavakat, illetve aromás aminosavakat. NH2 R OH O -aminosav R NH2 NH2 OH O -aminosav R OH HOOC NH2 O -aminosav p-aminobenzoesav A különféle típusú aminosavak közül legjelentősebbek az -aminosavak, mert ezekből épülnek fel az élő sejt anyagállományának nélkülözhetetlen alkotórészei a fehérjék. Sokféle fehérjét ismerünk, így a fehérje elnevezés gyűjtőfogalom, hasonlóan a szénhidrogénekhez. A közismert tojásfehérje is sok száz különböző fehérje vizes oldata, melyből körülményes munkával tiszta, egységes fehérjéket lehet elkülöníteni. Ezek teljes hidrolízisénél aminosavak, részleges hidrolízisénél pedig peptidek keletkeznek A fehérjék és peptidek teljes hidrolízisével mintegy 20-féle aminosav nyerhető: monoamino-monokarbonsavak, monoamino-dikarbonsavak, továbbá második bázisos
(aminovagy guanidino-) vagy egyéb (hidroxil-, szulfanil-) csoportot is tartalmazó aminokarbonsavak, valamint izo- vagy heterociklusos szerkezetű részeket is magukban foglaló aminokarbonsavak. Különleges szerkezetű hidrolízis termékek a prolin és a hidroxiprolin, melyek -helyzetben gyűrűbe zárt, bázisos jellegű iminocsoportot tartalmaznak 65 Alapvető fontosságú (esszenciális) aminosavaknak nevezzük azt a 9 aminosavat, amelyeket a szervezet nem, vagy csak elégtelen mennyiségben képes előállítani: metionin, treonin, lizin, izoleucin, valin, leucin, fenilalanin, triptofán. hisztidin Aminosavak nevének eredete Néva Származásb Megjegyzés Arginin L, argentum, ezüst Jól definiált ezüstsót képez. Aszparagin L, asparagus, Először spárgában mutatták ki. spárga Aszparaginsav Az aszparaginnal rokon. Cisztein A cisztin redukciós terméke. Cisztin Glutaminsav G, kisztisz, hólyag Először húgykőből állították elő. glutén +
amino A sikér (glutén) hidrolízisével állítható elő; a sikér a gabonák nagy fehérjetartalmú komponense. Glutamin A glutaminsavból származik. Glicin G, glikisz, édes Hisztidin G, hisztion, szövet Izoleucin Édes ízű. A leucin izomere. Leucin G, leukosz, fehér Fehér lapok formájában képződik. Lizin G, lizisz, kibontás A kazein hidrolízistermékei között fedezték fel. Metionin metil + tio Kénatomot (a kén görög neve theion) és hozzá kapcsolódó metilcsoportot tartalmaz. Prolin pirrolidin Pirrolidingyűrűt tartalmaz. Szerin L, sericum, selyem Először selyemből állították elő. Treonin treóz Térbeli konfigurációja hasonlít a D-treózéhoz (ez utóbbi négy szénatomos cukor) Triptofán tripszines + fán Fehérjék hasnyámirigybeli emésztésével képződhet; a tripszin a hasnyálmirigynedv fehérjebontó enzime, a fán a görög phanein, megjelenni igéből származik. 66 Tirazin G, tirosz, sajt A sajtban
található. Valin valerián Szénváza megfelel az izovaleriánsavénak. a Ezeket a biológiailag fontos -aminosavakat szinte sosem említik a szisztematikus nevükön. Az -in végződés b gyakori a nitrogéntartalmú vegyületeknél (amin-bázisoknál). L: latin, G: görög Az aminosavakat a szubsztitúciós nómenklatúra szabályai szerint nevezzük el, de a természetben előforduló aminosavaknak triviális nevük van. Ez utóbbi nevek szimbólumai az angol névváltozat első három betűjéből adódnak – például glycine (Gly), alanine (Ala) stb. H2N OH H2N O 2- vagy aminoecetsav glicin (Gly) OH O 2- vagy -aminopropionsav alanin (Ala) Tyr-Gly-Gly-Phe-Leu (= Leu-enkefalin) Tyr-Gly-Gly-Phe-Met (= Met-enkefalin) Az aminosavakból levezethető acilcsoport nevét a triviális név in végződésének il-re való cseréjével kapjuk. H2N H2N glicil- O O alanil- Az -aminosavak fizikai tulajdonságai Sav–bázis jelleg Az
-aminosavak kristályos, magas olvadáspontú vegyületek. Olvadáspontjuk sokkal magasabb, mint azoké a karbonsavaké vagy aminoké, melyekből helyettesítéssel levezethetők. Olvadáspontjuk fölött elbomlanak, gázhalmazállapotban nem létképesek Oldékonyságuk is a sókra emlékeztet. Szerves oldószerekben, például alkoholban a prolin és a hidroxiprolin kivételével gyakorlatilag oldhatatlanok, míg vízben valamennyi jól oldódik. Oldatban, az oldat pH-jától függően kationként, anionként vagy ún. ikerionos alakban vannak jelen. Minthogy e vegyületek egyidejűleg bázikusak és savasak, a savas csoport (–COOH) átadja a protonját a bázisosnak (–NH2) és így keletkezik az ikerionos forma. 67 Az aminosavak ikerionos szerkezetű molekuláinak ugyanannyi a pozitív töltése, mint a negatív. A molekulák „bruttó” töltése tehát nulla, azaz vizes oldatban izoelektromos állapotban vannak. Nyilvánvaló, hogy vizes oldatban az alábbi
sav–bázis egyensúlyi rendszer jelenlétével kell számolnunk: O H2N O OH O R H3O H3N H2O O R anion gyenge sav gyenge bázis ikerion H2O O H3N OH R kation Az -aminosavak térszerkezete Az -aminosavak molekulái – a glicin kivételével – királisak és ennek megfelelően két tükörképi konfigurációba rendezhetők, melyeket a Fischer-féle jelölést használva L-, illetve Dbetűkkel különböztethetünk meg. A természetben előforduló aminosavak túlnyomó többsége az L-sorba tartozik és (S)-abszolút konfigurációjú, mint azt az R-(+)-glicerinaldehiddel történő kémiai korrelációjuk, valamint röntgenvizsgálataik is igazolták. Az L-cisztein esetén a CIP szabály alapján a prioritási sorrend miatt nem az (S)-, hanem az (R)-konfiguráció adódik. 4 1 2 3 (R)-cisztein Érdekes, hogy mikroorganizmusok [Gram (+) és (–) egyaránt] a „nem fehérjealkotó” Dkonfigurációjú aminosavakat is képesek felépíteni. A közismert
antibiotikum, a penicillin egyik jellemző építőköve a ,-dimetil-D-cisztein (penicillamin). 68 penicillamin penicillin alapváz Leegyszerűsítve két különböző típusú sejtfal található a baktériumokban, ezek alapján Grampozitív és Gram-negatív baktériumokra lehet felosztani a fajokat. A név a baktériumfajok osztályozására régóta használatos Gram-festés eredményére utal. A Gram-pozitív baktériumok sejtfala vastag, sok peptidoglikán (olyan molekulák, amelyekben a peptidekhez poliszacharidláncok kapcsolódnak kovalens kötéssel), és lipoteichonsav réteget tartalmaz. A Gram-negatív baktériumok ezzel szemben viszonylag vékony sejtfallal rendelkeznek, mely csak néhány réteg peptidoglikánból áll, melyet lipopoliszacharidokat és lipoproteineket tartalmazó második lipidmembrán burkol. A legtöbb baktérium a Gram-negatív csoportba tartozik, csak a Firmicutes és Actinobacteria nemzetség tagjainak van Gram-pozitív sejtfala. A
felépítésbeli különbségek eltérő érzékenységet eredményeznek az antibiotikumokkal szemben, például a vancomycin csak Gram-pozitív baktériumokat tud elpusztítani, és Gram-negatív patogénekkel, mint például a Haemophilus influenzae vagy a Pseudomonas aeruginosa fajokkal szemben hatástalan. teichonsav vancomycin A Gram-festés egy sejtfestési eljárás; empirikus (gyakorlati) módszer baktériumok csoportosítására. A módszer Hans Christian Gram (1853-1938) dán kutató munkájának eredménye, aki 1884-ben felfedezte, hogy a baktériumokat két csoportra lehet osztani aszerint, hogy lilára festhetők-e vagy sem: Gram-pozitív baktériumok azok, amelyek kékre/lilára színeződnek és Gram-negatív baktériumok azok, amelyek rózsaszín/piros színt kapnak. 69 Aminosavak kimutatása: színreakció ninhidrinnel, csak rájuk jellemző (a prolin kivételével). Peptidek -Aminosavakból felépülő 2-100 egységből álló polimerek
Csoportosításuk oligopeptidek 2-10 aminosav polipeptidek 10-100 aminosav proteinek 100 > aminosav A peptidek szerkezete H2N COOH H2N Q COOH R H 3O (6M HCl) - H 2O O H2N R N Q COOH H savamid (peptid) kötés A peptideket nyílt láncú és nagy tagszámú gyűrűs peptidekre osztjuk. A nyílt láncú peptidekben a lánc egyik végén az aminocsoport szabad, ez az N-terminális rész (Nterminus), a másik végén a karboxilcsoport szabad, ez a C-terminális rész (C-terminus). Lúgos közegben anionként, savasban kationként vannak jelen, izoelektromos pontjukon pedig dipoláris ionkét. 70 Röntgendiffrakciós vizsgálatokkal megállapították, hogy a peptid molekulákban a kapcsolódó atomok egy síkban vannak, a savamid kötés transz-térállású, és a kötéstávolsági adatok szerint a C-N kötés a konjugációs kölcsönhatás következtében kettőskötés jellegű. A savamidokra jellemző konjugációs kölcsönhatás következtében a szabad
rotálás nem következhet be a savamid kötés mentén, így a stabilis transz-téralkat energetikailag kedvező állapotot biztosít a molekulának. Ugyanakkor a savamid kötés a legstabilabb kötés, csak erélyes körülmények között bontható fel (tömény sósav, forralás). Néhány jelentős természetes peptid Glutation: tripeptid, glu-cys-gly; oxidációs-redukciós folyamatok partnere, a szulfidcsoport diszulfiddá oxidálódik HOOC NH NH NH2 A SH O O COOH 2 G-SH AH2 G-S-S-G B BH2 Oxitocin és vazopresszin agyalapi mirigy hormonjai. oktapeptidek, majdnem azonos szerkezetűek, két aminosav különbözik bennük oxitocin: méhösszehúzó hatású, a tejelválasztást segíti elő vazopresszin: vérnyomás szabályozása és a vizelet kiválasztása (antidiuretikus hormon) 71 vazopresszin oxitocin Cikloproteid antibiotikumok: gramicidin-S (D-konfigurációjú aminosavat is tartalmaznak). -Amanitin: Gyilkos galóca (Amanita phalloides) A
gyilkos galóca háromféle toxincsoportot tartalmaz: amanitineket, falloidineket és virotoxinokat. Ezek olyan ciklikus oligopeptidek, amelyeket a szervezet enzimei nem tudnak lebontani, tehát hatástalanítani. A legveszélyesebbek közülük az amanitinek A lappangási idő hosszú, vagyis a tünetek csak jóval a gomba elfogyasztása után (8-24 óra múlva) jelentkeznek, amikor a méreg már felszívódott a tápcsatornából, ezért a gyomormosás nem sokat használ. A toxin a májkapuvénán keresztül a májba jut és egyenesen a májsejtekhez kötôdve, azok pusztulását okozza. Jelentősen károsodik a vese is Az amanitin hatása a sejtek DNS-től függő RNS polimerázának gátlásán alapul: a sejtben megszünik a fehérjeszintézis. Az -amanitin csak a melegvérű állatok DNS-polimerázára hat, ezért pl. a csigarágott 72 termőtest még lehet mérgezô! A gyilkos galócában található egyéb toxinok, a falloidinek és virotoxinok kevésbé mérgezôk és
rosszabbul is szívódnak fel. Mellitin (méhek fullánkmérge): Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro~~Ala-Leu-Ile-Ser-Trp-Ile-LysArg-Lys-Arg-Gln-GlnNH2 (vagy GIGAVLKVLTTGLPALISWIKRKRQQNH2) Inzulin (diabetes mellitis kezelése) Fehérjék nagy molekulasúlyú, többszáz aminosavból felépülő makromolekulák az élő szervezet legfontosabb anyagai 20-féle aminosavból épülnek fel, kapcsolódási lehetőségük korlátlan Csoportosítás 1) Összetétel alapján Protein (egyszerű), hidrolízissel -aminosavak képződnek Proteid (összetett protein), hidrolízissel -aminosavak és egyéb anyagok képződnek foszfoproteidek: kazein kromoproteidek: hemoglobin (színesek) mukoproteidek: szénhidrátot tartalmaznak lipoproteidek: zsírszerű anyagot tartalmaznak nukleoproteidek: nukleinsavat tartalmaznak, DNS metalloproteidek: fémek komplexei 2) Oldékonyság alapján Albuminok: vízben oldódnak (vérsavó, tojásfehérje)
Globulinok: neutrális sóoldatban oldódnak (fibrin) Prolaminok: vizes alkoholban oldódnak Hisztonok: ammoniával kicsaphatók Szkleroproteinek: oldhatatlanok, stabilisak (vázfehérjék) 3) Koaguálás alapján (fémion, sav, fizikai hatásra, hő, rázás hatására bekövetkező változás) Reverzibilis fehérjék (külső hatásra koagulálnak, a hatás megszűnése után visszaalakulnak): felvert tojásfehérje Irreverzibilis (denaturálás): rántotta 73 4) A fehérjemolekula alkata alapján Fibrilláris fehérjék: fonál alakúak (haj, izomrost) Globuláris fehérjék: gömb alakúak (sejt legtöbb fehérjéje) 5) Biológiai hatás alapján Inaktív fehérjék (vázanyagok): haj, köröm, bőr, kollagén (inak, kötőszövetek), miozin (izom) Fiziológiailag aktív fehérjék (bioregulátorok): anyagtranszportot szabályozzák hormonok (inzulin) enzimek (pepszin) vírusok (dohánymozaik-vírus) bakteriofágok toxinok (kígyómérgek)
antitestek Proteinek sajátságai Nagy molekulasúly, kolloid sajátságú anyagok Legtöbb liofil kolloid, vagyis oldószerrel szolvatálódnak, ezért duzzadnak meg oldódáskor Színreakciók kimutatásra Xantoprotein-próba: tömény salétromsav hatására a tirozin vagy triptofán aromás gyűrűjének nitrálódásával jellemző sárga szín keletkezik Biuret-próba: lúgos réz-szulfát oldattal élénk ibolyaszínű réz-komplex képződik (Magyarázat: melegítés hatására a fehérjék aminocsoportjából ammónia és biuret keletkezik, amely lúgos közegben réz(II)-szulfáttal vörösesibolya színű komplexet képez). Biuret allofánsav Ninhidrin-próba: kékes ibolyaszín ninhidrinnel (ld. aminosavaknál) O OH OH Amfoter jellegűek O 2,2-dihidroxiindán-1,3-dion A fehérjék primer szerkezete = a kapcsolódó -aminosavak sorrendje A fehérjék szekunder szerkezete Az alapkonformációt -kötések, ugyanakkor a legstabilabb állapot
kialakulását a nem kovalens kötések határozzák meg (hidrogénhidak, van der Waals erők). Röntgendiffrakciós vizsgálatok megállapították, hogy a polipeptidlánc térbeli elhelyezkedése a legstabilabb kétféle pozícióval: redőzött vagy -struktúra, ill. hélix struktúra 74 Redőzött struktúra A fehérjemolekulák között kialakul a hidrogénkötés, azonban a nagy térkitöltésű oldalláncok van der Waals taszítása következtében ezek nem lehetnek stabilisak. H O N R H H O R H N N N N O H R H O H R H O H H R O H H R O H N N N O H R H N N O H H R H O A peptidkötésnek olyan kedvező konformációt kell felvennie, hogy zavartalanul alakulhassanak ki a hidrogénkötések, és a van der Waals rádiuszok is megfelelőek legyenek. Az amidkötésben a nitrogénatom nemkötő elektronjai konjugációs kölcsönhatásba kerülnek a karbonilcsoporttal, ez azt eredményezi, hogy az amidkötés mentén a szabad rotálás
gátolt és így rögzített lesz. A szabad rotálás viszont az N-C(R)H ill. a H(R)C-C tengely körül lehetséges, úgy hogy az amidkötés síkja elfordul H R H O N N H O H R H O N N H O Az elfordulás következtében a közvetlenül kapcsolódó szomszédos atomok konformációja nem változik meg, ellenben megváltozik az egymáshoz kapcsolódó szomszédos atomok viszonylagos helyzete. 75 Ebben az esetben lesz a közvetlenül kapcsolódó atomok van der Waals rádiusza a legmegfelelőbb. A redőzött (plisszírozott) struktúra, mint energetikailag stabilis konformáció kialakulása, lehetővé teszi a peptidláncok közötti hidrogénkötések létrejöttét úgy, hogy az Rcsoportok is maximális távolságra kerüljenek egymástól. A selyemhernyó szál: fibroin, redőzött strukturájú, erős, de nem nyújtható, viszont hajlékony. Erős: stabilis H-kötések, ezért nem szakad el, és nem nyúlik meg Hajlítható: a gyengébb van der Waals
kölcsönhatások következtében, elcsúszhatnak a rétegek 76 Pókháló szerkezete: A szál belsejében kristályos területek is vannak, amiket amorf kapcsolódások választanak el. Hélix struktúra A fehérjelánc egy képzeletbeli henger palástján tekeredik fel csavarvonalszerűen = hélix. Az -hélixekben az N-H és C=O csoportok párhuzamosak a hélix tengelyével, míg az R-szubsztituensek a hengerpalástból kifelé állnak (extrovertált szerkezet). Minden egyes csoport olyan távolságra van egymástól, hogy intramolekuláris H-kötés alakulhat ki minden amidcsoport karbonilcsoportja és az előtte levő harmadik amidcsoport N-H-ja között. Az hélixben egy menetet 3-6 aminosavrész alkot, és 5 menet után kerülnek tökéletesen azonos helyzetbe. Az -hélix átmérője 10,5 Å, amely a legmegfelelőbb távolság a maximális van der Waals kölcsönhatásra. 77 -Hélix szerkezetű a fibrilláris fehérjék sorában tartozó keratin, amely a
haj, szőr, gyapjú, toll fehérjéje. Haj: 3-3 hélix tekeredik össze, háromszálú hélixet alkotva; ezek tovább rendeződnek, két háromszálú hélixet kilenc másik vesz körül, így stabilis, vastag kötegek jönnek létre, melyeket diszulfidhidak is összekapcsolnak, merevítenek. Tartós hullám (dauer) készítése: 78 Kollagén: a kötőszövetek, az inak, porcok fehérjéje. Aminosav tartalmának kb 1/3-a prolin és hidroxiprolin. Ezekből nem alakulhat ki sem -hélix, sem redőzött struktúra A láncok csaknem nyújtottak, meredeken csavarodó (egy menet kb. 30 aminosav) hélixet (-hélix) alkotnak úgy, hogy három lánc tekeredik össze és a molekulák közötti H-kötés tartja össze a láncokat. A kollagén rostok nem nyújthatók, meglehetősen szilárdak, így a szervezet számára kitűnő tartó, merevítő szerkezeti elemek. Szénhidrátok (cukrok) A cukor rövid története A legrégibb édesítő anyag a méz volt. A nádcukor hazája India Az
első hírt a cukorról Nagy Sándor két hadvezére hozta Európába Kr.e 327, indiai hadjáratukról hazatérőben. Akkor még a cukornád levét használták édesítőként A szilárd cukor felfedezése kb. Kre 300-600 körül tehető, ezt az indiaiak szákkárának nevezték, ami homokot jelent. Kínában is innen terjedt el Cukorgyártás kezdete: Perzsia, Kr.u V sz a perzsák a vörös színű nyerscukrot hívták szákkárának, a fehér kristályos cukrot kánd névvel hozták forgalomba. (innen a kandis cukor elnevezés, egykristály-cukor, jégcukor) Európában az arabok hozták be, kik meghódítván Perzsiát, a cukorgyártás mesterségét is eltanulták, szukhárnak nevezték, innen ered a neve. Az arabok hódításait nyomon követte a cukor elterjedése is. Cukor névadás: sakkara óind sukkar arab szakhar(on) görög saccharum latin sucre francia zucchero olasz Zucker német sukker norvég cukier lengyel cukor magyar, szlovák zahâr román 79 sugar angol caxap
orosz Magyarországon: kb. a XIV sz lett ismeretes; 1419-ben Zsigmond, 1476-ban Mátyás király ünnepi lakomáján szerepelt, mint drága asztaldísz. Először nagyrészt az olaszok készítették a cukros süteményeket, akik gyógyszerekkel is üzérkedtek. 1750 első finomító, Mária Terézia, Fiume, holland RT. 1747: Margraff András Zsigmond (1709-1789) német kémikus bebizonyította, hogy ua. az anyag van hazai növényekben is, pl a répában Achard Ferenc (1753-1821), fenti tanítványa, fektette le a gyártás alaptételeit répából. XVIII. sz Debrecenben épül kísérleti répacukorgyár, Gertinger János Sámuel eperjesi gyógyszerész támogatása által. Édesítőszerek: Szénhidrátok szerepe A szénhidrátok (cukrok) felépítésük szerint, a régi megközelítéssel a szén hidrátjainak tekinthetők. 1. energiahordozók 2. növényekben: fotoszintézis (CO2)n + (H2O)n h (CH2O)n + (O2)n klorofil üzemanyagpótló EtOH Szervezetben: cukorlebontás
iparban keményítõ glükóz H2O + CO2 675 kcal / mol 3. vázanyagok: a szénhidrátokból keletkező polimerek (cellulóz, kitin) 4. biológiai információk hordozói: A szénhidrátok és konjugátumaik (glikopeptidek, glikolipidek) az élő sejt felületén gondoskodnak a sejt adhézióról (tapadás), részt vesznek a sejt osztódás gátlásában, szerepük van a vírusok, baktériumok és hormonok valamint toxinok sejten való megkötődésében és irányítják az immunválaszt. Szerepük van az ivarsejtek egymásra találásában Mint nukleozidok alkotóelemei közvetői a genetikai folyamatoknak (RNS, DNS, receptorok a sejt membrán felületén / glikolipidek, glikoproteidok) 5. királis kiindulási anyagok A szénhidrátok felosztása egyszerű szénhidrátok: hidrolízissel nem bonthatók tovább 80 diszacharidok: hidrolízissel egyszerű szénhidrátokká bonthatók oligoszaharidok (összetett cukrok): tíznél kevesebb egyszerű szénhidrátot
tartalmaznak poliszaharidok (cukrokhoz nem hasonló, összetett szénhidrátok): tíznél több egyszerű szénhidrátból felépülő makromolekulák Egyszerű szénhidrátok Közös jellemvonásuk: Csoportosítás 1. hidrolízissel nem bonthatók fel általában édes ízűek vízben oldódnak Oxocsoport jellege szerint: aldózok ketózok O CH2 (CH)n C OH 2. OH OH OH aldóz O OH ketóz A kapcsolódó szénatomok száma szerint: aldóz trióz tetróz pentóz hexóz 3. CH2 (CH)n C CH2 H ketóz 0 1 2 3 n 1 2 3 4 Az oxocsoporttól legtávolabb levő szénatom konfigurációja szerint: D-, vagy Lkonfiguráció (a ketotrióz kivételével minden molekula egy, vagy több aszimmetriás centrumot tartalmaz) CHO H C OH CHO HO C H CH2OH C O H C OH CH2OH C O HO C H CH2OH CH2OH CH2OH CH2OH D- L- D- L- 81 Szénhidrátok térszerkezetének ábrázolása: Fischer-féle projekció ox C H red 2 CHO 4 H C OH 1 CH2OH 3 CHO CHO 2x OH HO H CH2OH CH2OH D
L CHO HO C CH2OH H HO CHO CH2OH R 82 CHO H OH HO H H OH H OH CH2OH CHO CHO CHO CH2OH CH2OH CH2OH D-galaktóz D-mannóz epimer cukrok egy OH konfigurációjában különböznek D-glükóz 8 db D 24=16 8 db L A szénhidrátok egyensúlyi elegyében a nyílt láncú forma és a ciklofélacetál öt- vagy hattagú gyűrűs állapotban található Haworth-Böeseken-képlet (piranóz, illetve furanóz, a megfelelő heterociklusok analógiájára): IR spektroszkópiával ugyanis nem mutatható ki a karbonilcsoport, tehát spontán, reverzibilis intramolekuláris nukleofil addícióval ciklofélacetálokként vannak jelen. O O pirán piranóz CHO CHO O O furán furanóz H O CH2OH C 2x csere O OH HOH2O O H HOH2C CH2OH H OH CH2OH O CH2OH H O H H OH + H OH -anomer -anomer 83 OH CHO CH OH OH HO O OH CH2OH HO H OH O OH + OH OH O H OH CH2OH -D-furanóz -D-furanóz A jobb oldali OH (Fischer képlet) alulra
kerül (Haworth képlet), a bal oldali OH (Fischer) felülre kerül (Haworth). Az anomerek keletkezésére (és tulajdonképpen a gyűrűs szerkezet kialakulására) a mutarotáció jelensége hívta fel a figyelmet. A kristályosítás módjától függően kétféle forgatóképességű D-glükóz (vagy egyéb cukor) ismeretes. jégecet [] = + 112,2° -D-glükóz szilárd oldat [] = +52,2o alkohol [] = + 18,7o -D-glükóz szilárd A kétféle D-glükózból, állás közben azonos [D] = +52,7o-os forgatóképességű oldat keletkezik. Ezt a forgatóképesség megváltozást nevezik mutarotációnak (mutáció = változás, rotáció = forgatás). A forgatóképesség megváltozása és azonos értékű végállapota egyensúly kialakulására utal. Mivel a mért érték nem középérték, azt jelenti, hogy az egyik anomerből több keletkezik, és ez a -anomer (63%), amelyik a stabilabb konformer, ebben ugyanis a hidroxil csoportok mind transz térállásúak
(-anomer 36%, nyílt forma 1%). Hexózok konformációja 84 a e e a O C1 konformer (stabilabb) 5 OH O 3 4 OH 4C 1 OH 6 5 1 4 O OH OH 2 OH O 1C konformer OH OH O OH 3 1 2 OH 4 5 HO HO 2 3 OH O OH 1 OH 4 C1 legstabilabb szerkezet H mind axiális OH, CH2OH mind ekv. csupa transz a felső és az alsó index a C-1 és C-4 szénatomok relatív helyzetére utal) -D-glükopiranóz Az oxocsoport reakciói Az aldozók kimutathatók ezüsttükör (ammoniás ezüst-oxid – Tollens)- vagy Fehlingpróbával (réz-szulfát + Na,K-tartarát + NaOH oldat), mivel kis mennyiségben nyitott formában is jelen vannak vizes oldatban. Tollens teszt Fehling teszt 85 Fontosabb monoszacharidok és rokon vegyületek D-Glükóz CH2OH CHO H OH HO H H OH H OH OH Ni / H2 HO H Bacterium xylinum red. H OH ox. (C-5 OH) H OH H OH O HO H HO H H OH H OH O HO H CH2OH CH2OH CH2OH CH2OH H CH2OH CH2OH D-szorbit L-szorbóz D-ribóz
és 2-dezoxiribóz (pentóz) A nukleinsavak építőkövei közé tartoznak. CHO CHO OH HO O OH OH OH CH2OH H OH H HO O OH OH OH OH OH CH2OH L-aszkorbinsav (C-vitamin) 2-dezoxi-2-keto-L-gulonsav -laktonjának enol alakja (gyűrűs észter forma) Szent-Györgyi Albert (1933 Nobel-díj) Lebontás (könnyen oxidálódik – levegőn is – a kettős kötés miatt): OH H OH O O - 2H H O OH L-aszkorbinsav C-vitamin források /100 g : Rosa canina COOH OH O + 2H OH COOH OH O HO OH dehidro-L-aszkorbinsav Capsicum annuum COOH OH O csipkebogyó: 400 mg zöldpaprika: 125-180 mg káposzta: 87 mg citrom: 45 mg burgonya: 24 mg tej: 1-2 (4-7) mg oxálsav ox. L-treonsav napi igény: 75 mg Brassica oleracea Citrus limon 86 Solanum tuberosum tej Diszacharidok a) Nem redukáló diszacharidok Két cukor glikozidos hidroxilcsoportjának kondenzációja (glikozid képzése) révén vezethetők le. Szacharóz (répacukor 20%, nádcukor 15%) „a cukor”
fruktofuranozid cukornád -D-glükopiranozil--D- cukorrépa A szacharóz híg ásványi savakkal vagy enzimatikus úton D-glükózra és D-fruktózra hidrolizál. A hidrolízis során a cukoroldat forgatóképessége folyamatosan csökken, eléri a nulla értéket, majd balra forgatóvá válik, mivel a fruktóz erősebben forgat balra, mint a glükóz jobbra. A forgatóképesség előjelének megváltozása miatt a szacharóz hidrolízisét invertálásnak, és az így nyert egyszerű cukor keveréket invertcukornak („műméz”) nevezik. A mézhamisítás leggyakoribb módja a virágmézként árult műméz. A műméz invertcukorból aromás anyagok (néha zamatos méz) hozzákeverésével és festékanyagok színezésével készül. 87 A hamisítást könnyen felismerhetjük, ha egy kávéskanálnyi mézet tiszta szeszben feloldunk. Amennyiben teljesen oldódik, úgy a méz tiszta. Ellenkező esetben homályos lesz és rövid idő múlva a belekevert anyag
leülepedik. b.) Redukáló diszacharidok A vízkilépés az monóz glikozidos hidroxilcsoportjából történik (4 vagy 6). OH HO O H OH OH OH -D-glükóz -D-glükóz OH OH valamelyik alkoholos - H2O O OH O H OH OH OH OH OH OH 6-(-D-glükopiranozil)-D-glükóz = genciobióz OH OH O H OH OH OH -D-glükóz -D-glükóz O OH H OH HO OH monóz O OH H OH OH másik OH OH O a 6 O OH OH és - H2O O H OH OH OH O OH OH OH 4-(-D-glükopiranozil)-D-glükóz = maltóz OH OH OH O O OH OH OH H OH O OH H HO OH OH -D-glükóz -D-glükóz O OH - H2O OH O OH H OH OH OH OH 4-(-D-glükopiranozil)-D-glükóz = cellobióz OH OH OH OH O OH OH OH H OH -D-galaktóz (C-4 epimer) O OH O OH H HO OH -D-glükóz OH - H2O O OH OH OH O H OH OH 4-(-D-galaktopiranozil)-D-glükóz = laktóz = tejcukor Genciobióz: a crocin összetevője, ami a sáfrány (Crocus sativus) sárga színéért
felelős (fűszernövény). Maltóz: malátacukor, a keményítő részleges hidrolízésével nyerhető. Cellobióz: a cellulóz részleges hidrolízésével nyerhető. 88 Laktóz: tejcukor, az emlősök tejének cukorkomponense (az anyatej 5-8% laktózt tartalmaz) Aminocukrok A természetben előfordulnak 2-amino-2-dezoxi, 3-amino-3-dezoxi, stb. monoaminohexózok Számos bakteriális poliszacharidban poliamino-polidezoxi cukor található A leggyakoribb aminocukor a glükózamin, a 2-amino-2-dezoxi-D-glükóz: OH O OH OH HO NH2*HX Diszacharidok közül említjük a kitobióz néven ismert 14-kötésű molekulát, mely 2glükózaminból épül fel: OH O OH OH O OH OH O NHR HO NHR kitobióz (R = H, ilyenkor HCl-só formájában van) kitin (R = CH3CO-) Kitin rákok, rovarok vázanyaga Kénsavval észteresített származékai: emberi, állati porcogó, inak, kötőszövetek „gélszerű” állományának alkotórészei Heparin véralvadásgátló, hasonló szerkezetű
poliszacharid (korlátozza a trombokináz enzim műkődését, amelynek a véralvadás előidézésében döntő szerepe van) kimutatás: májban, Mc Lean, 1916 89 OH O COOH O O O NaOSO2O OH OH OH NHSO2ONa O COOH O O O NaOSO2O NHSO2ONa OH O OSO2ONa Heterociklusos vegyületek Gyűrűs vegyületek, amelyek a szénatomok mellett heteroatomot(okat) is tartalmaznak, pl: O, N, S, valamint B, Si, P, As, Sb, Sn, Pb, utóbbiak mesterségesek. Felosztás 1. 2. gyűrűrendszer alapján a.) a gyűrűk tagszáma, heteroatom minősége és száma, helyzete szerint b.) a gyűrűk telítettsége szerint: telített, részlegesen telített, telítetlen gyűrűk elektronrendszere alapján: a.) aromás (heteroaromás) b.) nem aromás Nevezéktan a.) triviális név: barbitursav, piridin, atropin, flavon, stb b.) szisztematikus név: IUPAC (International Union of Pure and Applied Chemistry) Heteroatom jelölése: O oxa S tia N aza A Hantzsch-Widman rendszer végződései:
Gyűrűméret 3 4 5 6 7 8 9 10 prefixek, de ha magánhangzó következik, az a elmarad telítetlen -irén* -et -ol -in -epin -ocin -onin -ecin telített -irán* -etán -olán -án -epán -okán -onán -ekán * A tradicionális „-irin” végződés használható, ha a gyűrű csak nitrogént tartalmaz. * A tradicionális „-iridin”, „-etidin” és „-olidin” végződéseket preferáljuk a nitrogént is tartalmazó telített három-, négy- vagy öttagú gyűrűs heteromonociklusok esetén. 90 O O S S oxirén oxirán (etilén-oxid) tiirén O O S oxet oxetán O O oxol (furán) oxolán (T HF) O O N N H H tiirán azirin aziridin (etilén-szulfid) (etilén-imin) S N N tiet tietán azet azetidin S S N N H H azol pirrol azolidin pirrolidin tiol (tiofén) tiolán (THT) O S S H S N N H 2H-pirán (-pirán) 4H-pirán (-pirán) oxán 2H-tii n 4H-tii n tián piridin (THP) (-tiopirán) ( -tiopirán) (perhidrotiofén) A
számozás mindig a heteroatomon kezdődik! Több azonos heteroatomot tartalmazó gyűrűk elnevezése azinán (piperidin) 91 *az oxin név nem használható a pirán esetében, mivel ezt korábban a kinolin-4-ol triviális neveként használták * az azin név nem használható a piridin esetében, mivel ez régóta használatos az =N-N= típusú vegyületcsalád elnevezésére H2N NH2 R CH O - H2O R O N NH2 CH R - H2O hidrazon R N N R azin Eltérő heteroatomot tartalmazó gyűrűk elnevezése Kondenzált heterociklusok elnevezése 4 c 3 b 2 5 a O 1 O benzo-(2,3)-furán benzo[b]furán (kumaron) O O furán benzo-(3,4)-furán benzo[c]furán (izokumaron) Öttagú heterociklusos vegyületek ' ' O furán O benzofurán S tiofén N H pirrol O dibenzofurán S benzotiofén N H benzpirrol (indol) N H dibenzpirrol (karbazol) dibenzofurán 92 Kötésrendszer N H N H H N 0,2 - 0,2 - 0,2 - 0,2 N 0,8+ H A nemkötő
elektronpár részt vesz az aromás rendszer kialakításában A heteroatom Y sp2-hibridállapotú és parciális pozítiv töltés kerül rá, ha a nemkötő elektronpárja delokalizálódik a gyűrűben. Ennek a delokalizációnak a csökkent dipólus momentum a következménye, ha összehasonlítjuk a megfelelő telített származékokkal. A furán és a tiofén esetében a rezonancia hatása nem elég ahhoz, hogy túllépje az elektronegativitás mértékét, ezért a negatív pólus a heteroatomokra tevődik. A pirrol esetén a rezonancia hatása a dipólus momentumra olyan erős, hogy megfordul ennek iránya. aromás jelleg: tiofén > pirrol > furán k SE benzol < pirrol(,’) > tiofén < furán reaktivitás: pirrol > furán > tiofén > benzol Reaktivitás Bázikus jelleg Pirrol: nem bázikus, ez a nemkötő elektronpár delokalizációjára utal. N H pKb szek. amin, erős bázis 3,2 N H nem bázis 13,6 93 Furán: enol-éter (konjugált dién)
jellegű, sav hatására gyűrűfelnyílás, majd gyantásodás következik be (mivel az aromás rendszer szűnik meg, hosszas savas főzés, nagy savkoncentráció szükséges). H2O H H2O O O -H OHC OH HO H enol CHO gyanta szukcinaldehid Savas jelleg Pirrol: a konjugáció következtében a heteroatomon lecsökken az elektronsűrűség, így N-H savként működik. Ezért reagál káliummal vagy Grignard-reagenssel, és ebből kifolyólag számos származék állítható elő. K N N H + 1/2 H2 K Q-Hlg pKa ~ 15 RMgX Q-Hlg N N Q H Q Q = alkil, acil N MgX , majd víz CO2 N O N C OMgX COOH H Elektrofil szubsztitúciós reakciók A -komplex kialakulása könnyebben megy végbe, mint a benzol esetében, a -komplex pedig az szénatomon kedvező. H H E X E H X X E X H E X E H X E Hammond-elv! 94 Stabilabb átmeneti állapoton keresztül kedvezőbb a reakció, tehát a szubsztitúció helyzetben játszódik le. Reakciók
Brómozás, nitrálás, szulfonálás: Br2 / 0oC Br2 / 5oC X X Br X NO2 Br Br X HNO3 Ac2O X A nitrálás nem érintheti a heteroatomot, ezért használunk enyhébb reakciókörülményeket: HNO3 H O NO3 O O O OH O - AcOH H3C C O NO3 H3C C O O O N O O H3C C Hajtóerő: az acetát anion nagyfokú stabilitása Öttagú heterociklusok benzológ származékai X X Fontosabb vegyületek: O benzofurán NH benzopirrol (indol) O NO2 95 HO COOH NH2 N NH2 N H H triptofán (Trp) szerotonin (vérnyomás hormonja) HO COOH NMe2 N N H H bufotenin (varangyméreg- Bufo bufo) mérges gombákban is 3-indolilecetsav (heteroauxin - növényi növekedési hormon) Európai közönséges varangy Bufo bufo A szerotonin a vérnyomást szabályozza, felhalmozódása esetén alszunk, eközben elbomlik, ekkor ébredünk. Ha gátolt a képződése, a kóros álmatlanság lép fel Alkohol hatására képződik. Az indolilecetsav a növények hosszanti
növekedéséért felelős; a hasonló szerkezetű klórfenoxiecetsavak ellentétes hatásúak (auxinantagonisták): O COOH Cl herbicid (gyomirtó) Indigó Az Indigofera fajok tartalmazzák az indoxil-glükozidot, az indikánt, amely enzimatikusan hidrolizál indoxillá. Az indoxil levegőn, állás közben kék színű, a vízben oldhatatlan indigóvá oxidálódik. OH H O O OH OH OH OH O H - glükóz N N N H H H (glikozid = aglikon + cukorrész; glükozid = aglikon + glükóz) H N O2 enzim N O O 96 Öttagú, két heteroatomot tartalmazó heterociklusok N N N O S N H oxazol tiazol imidazol 1,3-diazol O N S N N H izotiazol izoxazol N pirazol 1,2-diazol N N N O S benzoxazol benztiazol N H benzimidazol Kötésrendszer N N N SE N H ' " N N H ' - 1/2 + 1/2 ' Az imidazol tökéletesebb aromás rendszer, mint a pirrol. Bázikus
tulajdonságú vegyületek, de a pirazol és az imidazol, savas protonjuk miatt, amfoter jellegűek 97 imidazol N N N N N N N N H H R R 4 2 H 5 N N N H H N3 1 1 N 4 HN NH 3N H 2 4(5)-R-imidazol gyors protonvándorlás (virtuális tautoméria) Az R csoport jelenlétében, már nem azonos a két tautomer. pirazol : csak dimer N N H H N N Természetes vegyületek Alapvázak: 4 pirrol gyűrű, metilénhidakkal összekötve 2 CH CH 3 1 CH 4 NH NH N HC HC 5 8 CH porfin HN N 8 6 N CH HN N 7 CH N N 7 CH N NH CH CH klorin korrin Hemoglobin A hemoglobin a gerincesek vörös vérsejtjeiben lévő összetett fehérje (kromoproteid). Oxigénszállító szerepét régen felismerték és már 1862-ben kristályosan el is tudták különíteni. A hemoglobin fehérjementes része egy szubsztituált porfinvázas vegyület a porfirin vas(II)komplexe. A hem totálszintézisét és ezzel szerkezetének felderítését H Fischer (1929)
valósította meg. A fehérjerész hisztidin nitrogénje a porfinváz síkjára merőleges irányból koordinatíve kapcsolódik a központi vas(II)-atomhoz. Ezzel ellentétes oldalról a vas(II)-atom egy oxigénmolekulát képes megkötni. Az oxigéntartalmú fehérjét oxihemoglobinnak nevezzük. 98 CH2 HC CH3 CH H3C N HC N H3C O CH CH2 N II Fe N N N N CH3 H2C H2C N Fe CH CH O kordinatíve kötött oxigén N fehérje CH2 CH2 COOH NH COOH a hemoglobin hemje a hem síkja a fehérje hisztidin része az oxihemoglobin szerkezete Szénmonoxid mérgezés: Karboxihemoglobin Epefestékek Az epefestékek szerkezetileg és genetikusan szorosan összefüggnek a purinvázas vegyületekkel. A hemoglobin hemjének természetes lebomlási termékei, melyek vasmentesek és már nem tartalmaznak porfinvázat. Az oxidatív lebomlás főként a májban megy végbe A hemoglobin hemjéből először biliverdin képződik, ami enzimes redukcióval bilirubinná alakul. A
bilirubin tovább bomlik egyéb pirrolvázas vegyületekké, majd kiürül a szervezetből hemoglobin hemje biológiai oxidáció COOH COOH H3C HO N CH2 CH2 CH2 CH2 CH H3C CH2 CH2 CH3 H3C CH CH N CH N CH N OH H biliverdin redukció COOH COOH H3C HO N CH2 CH2 CH2 CH2 CH H3C CH2 CH2 CH3 H3C CH CH N CH2 H N H bilirubin CH N OH 99 Klorofill A klorofill a Nap sugárzó energiáját abszorbeálja és közvetíti a növényi sejtek energiát igénylő szintetikus folyamatai számára. A klorofill viaszállományú, rendkívül érzékeny vegyület, ami már enyhe behatásra (levegő, fény, savak, lúgok stb.) is irreverzibilis változást mutat. A klorofillt Willstätter (1904-1913) különítette el először tisztán és megállapította, hogy két hasonló szerkezetű anyag keveréke. A két vegyület, a klorofill-a és a klorofill-b csak a 3-helyzetű szénatom szubsztituensében különböznek. A 7,8-dihidro-porfinváz komplex kötésű
magnéziumot tartalmaz. A gyűrű oldalláncában lévő egyik karboxilcsoportot egy diterpénalkohol, a fitil-alkohol észteresíti. H2C HC R CH H3C 3 N CH Mg HC N N H3C H H2C CH2 CH3 N CH3 C H H2C H O C O O COOCH3 CH3 H3C fitil-csoport H H3C CH2 H CH3 CH3 klorofill-a (R=CH3) klorofill-b (R=COH) B12-vitamin A B12-vitamin hiánya vészes vérszegénységet okoz. A betegség kezelésére korábban máj kivonatot használtak, de a tiszta hatóanyagot a sztreptomicin gyártás során visszamaradó anyalúgból izolálták (Folkers, 1948). A B12-vitamin sötétvörös kristályos vegyület, optikailag aktív – vizes oldata balra forgató. Szerkezetét röntgendiffrakciós módszerekkel 1957-ben tisztázták, amit 1971-ben totálszintézissel igazoltak (Woodward, 1971). A B12-vitamint szerkezete alapján cianokobalaminnek nevezték el. A korrinvázas vegyület középpontjában kobalt(III)-atom található, ami a gyűrű nitrogénjeihez egy kovalens és három
koordinatív kötéssel kapcsolódik. A korrinváz nem teljesen síkalkatú, mivel a folytonos konjugáció csak 13 atomra terjed ki. A kobaltatomhoz a négy nitrogénatom síkjára merőlegesen felülről egy ciáncsoport kapcsolódik kovalens kötéssel, alulról pedig a benzimidazolgyűrű nitrogénjével létesít koordinatív kötést. 100 O H2N C CH2 CH2 CH3 O H3C C H2N C CH2 H3C O H H2N C CH2 N CN O H3C N CH Co N N CH2 C NH2 O H CH2 CH2 C NH2 CH3 O H C H CH3 O C CH2 CH2 CH3 CH3 CH2 CH2 C NH2 NH O CH3 CH2 CH O N P CH3 OH O O N CH3 HO CH2 O B12-vitamin (cianokobalamin) A B12-vitamin biológiailag aktív formájában a ciáncsoport helyett adenozintrifosztát kapcsolódik a kobaltatomhoz. Imidazol gyűrűt tartalmazó aminosav az L-hisztidin: -(4-imidazolil)-L-alanin O N N H OH enzim N CO2 N H NH2 NH2 hisztamin A hisztamin a hajszálereket tágítja, serkenti a simaizom működést. Allergiás tüneteknél nagy mennyiségben kerül a szövetnedvekbe.
Hisztamint tartalmazó vagy hisztamint felszabadító élelmiszerek: - halak: tonhal, szardínia, szardella, füstölt hering, ikra - érett sajtok: ementáli, camembert, rokfort, stilton, gouda, cheddar, minden penészes és füstölt sajt - alkoholok: vörösbor, fehérbor, pezsgő, sör, - húsfélék: érlelt kolbász, sonka, szalámi, füstölt hús, sertéshús - zöldségek, gyümölcsök: spenót, borsó, lencse, bab, savanyú káposzta, paradicsom, ketchup, eper, papaya, ananász, szója, mák, mogyoró, mogyorókrém - egyéb: tojásfehérje, csokoládé, fahéj, sörélesztő. Az álallergia oka: Egészséges emberekben a hisztamint a máj lebontja, normális körülmények közt a hisztamintakár nagyobb adagok bejutása esetén is képes lebontani szervezetünk. Súlyos problémát csak azoknál okoz, akiknek szervezete erre nem képes - ilyenkor az élelmiszerrel bevitt hisztaminmennyiség hisztaminmérgezést eredményez. Ha valakinek a szervezete már igen csekély
mennyiségre allergiás tünetekkel reagál, akkor szervezetéből hiányzik az az enzim (diaminoxiáz), amely lebontja a hisztamint. Ennek hiányában a fehérjéből és a hisztamindús élelmiszerekből származó hormonszerű anyag nagymértékben felhalmozódik a vérben. Heves, allergiaszerű tünetek jelennek meg, anélkül, hogy az immunrendszer valójában részt vett volna a panaszok kialakulásában (a vizsgálatok IgE ellenanyag- és 101 eozinofil fehérvérsejt-felszaporodást nem mutatnak). Ezért nevezik az állapotot pszeudovagy álallergiának A tüneteket többnyire valamilyen gyógyszer, élelmiszer-adalékanyag, vegyszer vagy konzerválószer (szalicilsav, benzoesav) váltja ki. Amidazophen: fájdalom- és lázcsillapító Gombamérgek Muszkarinszindróma: Amanita muscaria (légyölő galóca), Clytocibe (fehér tölcsérgomba), Inocybe (susulyka) (hallucinogének). Clytocibe Inocybe Amanita muscaria 102 Hattagú, oxigéntartalmú heterociklusok O O
piriliumion O benzpirilium O O O O piron benzpiron (kromon) Pirán-származékok Me OH HO Me Me O Me O Tokoferol (E-vitamin) Hasis (marihuana) vadkender Cannabis sativa Az emberben a tokoferol hatása kevéssé ismert, hiánya nem okoz jellemző tüneteket. A tokoferolok könnyen oxidálódnak, miközben antioxidáns hatást fejtenek ki, így megakadályozzák a többszörösen telítetlen zsírsavak oxidációját. Biológiailag a D-alfatokoferol a leghatásosabb E-vitaminban gazdagok a növényi olajok, zöldnövények, gabonamagvak, de főleg a csíráztatott magvakból nyert olajok. Flavonoidok hidroxilcsoportokat tartalmazó fenilkromán-származékok, melyek szabad, illetve glikozidjaik formájában fordulnak elő a növényvilágban 103 OH HO O Odiglikozid O OH OH rutin (P-vitamin) (aglikon = kvercetin) Hajdina (Fagopyrum esculentum) flavus = sárga (latin); erek permeabilitását befolyásolja (vérzékenység) (OH)n: 640 db. (OH)n(OCH3): 38627
db. OsteochinR (Chinoin) = 7-izopropiloxiizoflavon (csontritkulás előrehaladását csökkenti) O Ph O O Osteochin Flavin 7: A Flavin 7 termékek tartalma: flavonoidok (kvercetin, rutin, miricetin, kempferol, izoramnetin, malvidin-3-glükozid, katechin, krizin, galangin, apigenin, fizetin, luteolin, morin és sok más, kisebb mennyiségben előforduló flavonoid), rezveratrol (transz-, cisz-, valamint ezek glükozidjai), egyéb, az alapanyagul szolgáló gyümölcsökben található növényi antioxidánsok, vitaminok, ásványi anyagok, nyomelemek. A Flavin 7 összetevõi: 7 féle gyümölcsbõl készül, vörösszõlõ feketeszeder, feketecseresznye, feketeribizli, pirosribizli, szilva, alma. Minimális alkoholtartalma is van. Rezveratrol Antocianinok glikozidok, hidrolízisük antocianidineket és cukrokat eredményez. A növények színét adják. OH OH OH HO O Cl cianidin-klorid (vörös) OH OH OH HCl HO O O OH kék O 104 A piros muskátli, szegfű,
ha bázikus talajba kerülnek, kékek lesznek. Hattagú, nitrogéntartalmú heterociklusok Piridinszármazékok O O COOH ox. N Me N (-) nikotin C N N nikotinsav nikotinsav-amid C NH NH2 NH2 N izonikotinsav-hidrazid OH HO b a N 2 1 kinolin benzo[b]piridin 1-azanaftalin OH Me N piridoxin (B6 vitamin) Kötésrendszer 0,140 nm N 2 0,139 nm N N N 0,134 nm c 10 b a N izokinolin benzo[c]piridin 2-azanaftalin 0,967 +0,17 +0,05 +0,05 N -0,57 (h12h21h312pz1) 1,004 N 0,998 1,048 elektronsûrûség sp = 2,21 D Stab. energia: 146,65 kJ/mol k: SE -helyzet < benzol SN -helyzet (Csicsibabin reakció) Bázicitás: A nitrogén sp2 hibridállapota miatt nagyobb az s orbitál hányad, az elektronok nagyobb magvonzás alatt állnak, ezért a piridin gyengébb bázis, mint a tercier amin. Savmegkötőként alkalmazzák a szerves kémiai szintézisekben. pKb N N N 4,2 8,8 H ox. (persav) N Pd(C) / H2 vagy Fe / AcOH MeI / N N I
O Me piridin-N-oxid N-metilpiridinium-jodid terc-aminra utaló kvaternizálás Papaverin: izokinolinszármazék 105 A mák (Papaver somniferum) egyik alkaloidja spazmolitikum (simaizom görcsoldó) MeO N MeO CH2 MeO MeO No-spa: görcsoldó készítmény (Chinoin) MeO MeO N Piridoxin (adermin, B6-vitamin) hiánya patkányon bőrgyulladást okoz rizskorpa, élesztő tartalmazza OH H CH HO OEt OH Me op. 136oC N OEt Piperidin származékok Fentanyl: fájdalomcsillapító, enyhe narkotikum O N N [N-fenil-N-(1-feniletil-4-piperidil)]propionsav-amid Piperin: a bors tartalmazza, transz-transz izomer, cisz változata a kavicin, ami a bors csípős ízéért felelős. O C N O O O O C N O piperin kavicin 106 Hosszabb állás után, a bors elveszti csípős ízét, mert a kavicin a stabilabb piperinné izomerizálódik. Feketebors (Piper nigrum) Hattagú, két nitrogénatomot tartalmazó heterociklusok 3 1 2 2 N N N N 1 piridazin
1,2-diazin N N 3 N N pirimidin 1,3-diazin pirazin 1,4-diazin SE N sp2 (h12h21h312pz1) N " ' ' N N SN pKb: 12,7 (piridin 8,8) az elektronfelhő erősen torzult Pirimidinszármazékok biológiai tulajdonságai 1. Az uracil, timin, citozin a nukleinsavak építőkövei O O OH NH CH3 O N O H barbitursav N uracil O N O timin (5-metiluracil) NH2 NH2 N N N NH N NH H OH OH O CH3 N N OH 2,4-dihidroxipirimidin N OH citozin N H O 107 2. B1-vitamin (aneurin = tiamin-hidroklorid): szénhidrát anyagcsere, főbb energiaszolgáltató folyamatok, idegek működése, idegrendszer energiaellátása, szívműködés Cl N Me Me OH N N NH3 Cl S 3. A barbitursav 5,5-diszubsztituált származékai bénítják az idegrendszert Az adagolástól, alkalmazástól (perorális vagy intravénás) függően altató-, nyugtatóhatást vagy narkózist idéznek elő OH N HO N OH Et Et OH N HO Veronál Et Ph N OH Luminal
Néhány ismert barbiturát „rajongó”: Ryunosuke Akutagawa – japán író, (“Az éneklő borz”) barbiturát túladagolás következtében halt meg (öngyilkosság), július 24, 1927. Adolf Hitler - metamfetamin és kokain élvező volt, barbiturátokat szedett alvászavar ellen. Judy Garland véletlen barbiturát túladagolásban halt meg. Marilyn Monroe, George Sanders: amerikai színészek is. Jimi Hendrix: barbiturát túladagolás és hányás belélegzése Johnny Cash: túlzásba vitte a barbiturátok szedését karrierje csúcsán Elvis Presley: utolsó éveiben sok barbiturátot szedett, de vitatott, hogy ez hozzájárult volna a halálához Margaux Hemingway: amerikai színésznő, az író unokája, fenobarbitál túladagolásban hunyt el Pier Angeli: színésznő, 1971 Jean Seberg: színésznő, Párizs, 1979, mindketten barbiturát túladagolás 4. A szulfapirimidinek baktericid szerek: R N H2N SO2 HN N Szulfaguanidin
(R, R' = H, Me) Szuperszeptil (R,R' = Me) R' 108 Purinvázas vegyületek Purin = imidazo[4,5-d]pirimidin E. Fischer régi képlete: 1N 6 CH 7 2 C 5 C NH a d CH 8 3N C N b c 9 4 H H N N N N HO N purinváz N HO OH N H O H N N N N O Me koffein 1,3,7-trimetilxantin Kávécserje (Coffea arabica) N H2N N H guanin 2-amino-6-OHpurin O Me N Me N O Me teobromin 3,7-dimetilxantin N N adenin 6-aminopurin N N N H O Me N N N húgysav 2,6,8-triOHpurin O Me N H xantin 2,6-diOHpurin OH NH2 N N N N OH N N N N H OH H N N N N Me H teofillin 1,3-dimetilxantin Teacserje (Thea sinensis) 109 Nukleinsavak 1865-ben egy brüni (Brno) apátságban magányosan kertészkedő szerzetes, Gregor Mendel néhány kvantitatív következtetést von le borsókeresztezési kísérleteiből, és ezzel anélkül, hogy tudna róla - megalapozza korunk talán legfontosabb tudományát, a genetikát. Felismerései annyira újszerűek, hogy
noha dolgozatát kora egyik vezető biológusának is elküldi, azok nyomtalanul és visszhangtalanul süllyednek el, amíg 1900-ban hárman (DeVries, Correns, Tschermak) újra fel nem fedezik őket. Négy évvel Mendel dolgozata után, 1869-ben, egy bázeli katonaorvos, Friedrich Miescher sebesült katonák gennyel átitatott kötéseiből izolál és ír le egy új, foszfortartalmú, nagymolekulájú szerves anyagot, amelyet nukleinnek nevez el (ma DNS-nek hívjuk). Ez a felfedezés is meglepő, olyannyira, hogy a kor biokémikus pápája, Hoppe-Seyler két évig visszatartja a közleményt, amíg saját maga meg nem ismétli Miescher kísérleteit, így meggyőződvén azok hitelességéről. Gregor Mendel (1822-1884) Friedrich Miescher (1844-1895) Nagy tömegű, polimer vegyületek, az élő szervezetben a genetikai információ tárolását és a peptidek, valamint a fehérjék bioszintézisét irányítják. A nukleinsavak építőkövei A különféle sejtekből nyert
nukleinsavak teljes hidrolízisével pentózokat, purin- és pirimidinbázisokat, valamint foszforsavat lehet izolálni. Építőegységek: nukleotidok = szerves bázis + cukor + foszforsav nukleozidok = cukor + szerves bázis 110 nukleoprotein (protamin + nukleinsav) hidrolízis (víz) nukleinsavak RNS / DNS (polimer) fehérje (protamin) hidrol. nukleotidok (monomer) hidrol. (OH ) nukleozidok H3PO4 hidrol. (H3O ) 5 HO pirimidin és puringyûrûs vegyületek O NH2 Me NH O uracil U RNS N NH 2 timin T DNS N N citozin C RNS / DNS N HN NH N D-ribóz 2-dezoxi-Dribóz O NH2 NH O OH R OH HN HN 1 3 O O O 4 pentózok H2N NH N adenin A RNS / DNS guanin G RNS / DNS Nukleozidok szerkezete (N-glikozidok) RNS ribonukleozidok NH2 6 N1 7 N 8 HO N 9 O N 3 2 O N HO adenozin 9-(-D-ribofuranozil)adenin guanozin 9-(-D-ribofuranozil)guanin NH2 1N O O HO OH 6 N 3 N OH OH OH OH N O NH O 5 4 OH citidin
3-(-D-ribofuranozil)citozin HN O O HO OH N OH uridin 3-(-D-ribofuranozil)uracil NH2 R OH H 111 DNS dezoxiribonukleozidok NH2 N 5' HO N O 4' 3' OH 2' O N N HO N N O NH2 OH dezoxiguanozin 9-(2'-dezoxi--D-ribofuranozil)guanin O NH2 Me HN N O O N 1' dezoxiadenozin 9-(2'-dezoxi--D-ribofuranozil)adenin HO NH N HO O O N OH OH dezoxicitidin 3-(2'-dezoxi--D-ribofuranozil)citozin timidin 3-(2'-dezoxi--D-ribofuranozil)timin Ha a timidinben a 3’-OH = N3 (azidocsoport) „AZT” (AIDS vírus szaporodását csökkenti)) Zidovudine Nukleinsavak primer szerkezete A polinukleotid láncban a láncvégeken csak az egyik hidroxilcsoport észteresített. A tapasztalat szerint P-terminális az 5’-helyzetben van észteresítve, míg az O-terminális (vagyis a szabad hidroxilcsoport) 3’-OH csoport. Formailag úgy tekinthető a polinukleotidlánc, hogy bennük a nukleozid-5’-foszfátok
acilezik egymást a 3’-helyzetű hidroxilcsoportokon keresztül. DNS-molekulákban általában nincs szabad láncvég, gyűrűvé záródnak össze a láncvégek. A polinukleotidlánc alapváza a polifoszforsav-diészter makromolekula, mely pentózfoszfát összekapcsolással alakul ki. 112 2 1 HO N O pentóz O P O 3 N O pentóz O P O OH n N pentóz O O N O pentóz O P OH OH OH O-terminus P-terminus A polinukleotid lánc primer szerkezete O 5’-vég felé HO O timin H3C O P NH O O N CH2 O H H H H O O O P adenin NH2 N pK=3,8 N O N CH2 O H H H H O O P O N pK=4,5 NH2 N citozin O N CH2 O H H H H O O P O O guanin O N NH O N CH2 O H H H H OH 3’-vég felé N pK=2,4 9,4 NH2 Nukleinsavak másodlagos szerkezete Watson és Crick, 1953 a nukleinsavak szerkezetére tettek javaslatot: két lánc, spirális, egyetlen tengely köré csavarodva, jobbraforgó spirál, de a molekulák a két láncban ellentétes irányban haladnak. A két
láncot purin- és pirimidin-bázisok kapcsolják össze A bázisok 113 síkja merőleges a fonal tengelyére. Párokban kapcsolódnak, az egyik lánc bázisa hidrogénhíddal kötődik a másik lánc bázisához. Az egyik purin kell legyen, a másik pirimidin ahhoz, hogy a kapcsolódás kialakulhasson. A feltételezett specifikus párosodás a genetikai anyag lehetséges másoló mechanizmusára utal. A és T, valamint a G és C hidrogénkötéssel kapcsolódhatnak össze, így a bázisokhoz kötődő dezoxiribóz molekulák csaknem azonos távolságra kerülnek egymástól (~ 11 angström) o 2.8 A H N H O N H N o 2.9 A Me N H N N N N O cukor A N H N N H O N N cukor o 11.1 A H N O N cukor cukor H o 10.8 A T G C Azonos típusú bázisok között nem tud kialakulni stabilis hidrogénkötés, másrészt a cukormolekulák túl messze, vagy túl közel lennének egymáshoz. H H N H N N O N H N N N o 13.5 A A N H N O O cukor H cukor Me N N
N H N cukor O N H N cukor o 8.5 A G C túl hosszú T túl rövid A purin- és pirimidinbázisok eltérő kapcsolódása (pl. A-C) sem jöhet létre, mivel így nem tudna kialakulni stabilizáló hidrogénkötés. H H N H N N N H N N N N O cukor A cukor C 114 A kettős spirál szerkezete A DNS önreprodukciója: DNS-polimeráz enzim hatására szétcsavarodik, és ezzel párhuzamosan megindul a komplementer szál képződése. Ez dezoxiribonukleozid-5’-foszfátból képződik úgy, hogy két szomszédos nukleozid-trifoszfát között - pirofoszforsav lehasadással – az enzim foszforsavdiészter kötést hoz létre. Az eredeti bázishoz hidrogénkötéssel kapcsolódik a komplementer bázis, és így kialakul az új kettős hélix. 115 Az RNS szerkezete Egy szálból épül fel, rövidebb nukleotid láncot tartalmaz. A fehérje szintézisért felelős
képlet: ROR’, illetve RSR’ a.) Szubsztitúciós név: R’O, R’S előtag + RH alapvegyület b.) Csoportfunkciós név: betűrendben, kötőjellel elválasztva az R, R’ csoport neve + kötőjel + éter/szulfid funkciós csoportnév O(S) O(S) a.) 1-propoxi(propilszulfanil)pentán b.) propil-pentil-éter(szulfid) O(S) Cl 1-etoxi(etilszulfanil)-2-klóretán etil-(2-klóretil)-éter(szulfid) etoxi(etils zulfanil)etén etil-vinil-éter(szulfid) Ciklusos éterek a.) heterociklusos vegyületként b.) epoxi mint elváló előtag, + alapnév c.) alapnév + oxid funkciós csoportnév 2 O O 3 a.) oxirán b.) c.) etilén-oxid 2 3 O 7 4 1 2-etil-2-metiloxirán 1,2-epoxi-2-metilbután 1 5 6 7oxabiciklo[4.10]heptán epoxiciklohexán ciklohexén-oxid Kötésrendszer A C–S kötés apoláros, mivel a szén- és kénatom elektronegativitása azonos (2,5). A kénatom elektonegativitása kisebb, mint az oxigénatomé (3,5) és a kén központi atommagtöltését két
lezárt elektronhéj is árnyékolja (O: 1s2, 2s22p4; S: 1s2, 2s22p6, 3s23p4), s így az atommag pozitív töltésének a viszonylag távoli vegyértékhéjra gyakorolt hatása csekély mértékű. 3 Az éterek és tioéterek kötésszögében is eltérés mutatkozik, azonos szubsztituensek esetén a kénvegyületekben a kötésszögek jóval kisebbek. Fizikai tulajdonságok A kénatom nagyobb méretű és könnyebben polarizálható, mint az oxigén, ezért az S– H kötés gyengébb, mint az O–H kötés. Ebből következik, hogy a tiolok nemcsak az alkoholoknál, hanem a víznél is erősebb savak, így már vizes lúggal is sót képeznek. kén-hidrogén (pKa=7,04) HS H + H2O HS + H3O tiolok (pKa=8) RS H + H2O RS + H3O CH3 CH2 CH2 SH + KOH propán-1-tiol CH3 CH2 CH2 SK + H2O kálium-propán-1-tiolát káliumprop-1-il-szulfid A fentiekkel függ össze, hogy az alkiltiolát-anion gyengébb bázis, ugyanakkor erősebb nukleofil, mint az alkoxidion. A gyengébb
S–H kötéssel kapcsolatos a tiolok nagyfokú érzékenysége oxidálószerekkel szemben. Már a levegő oxigénjének vagy más enyhe oxidálószernek (pl. I2 vagy K3[Fe(CN)6]) a jelenléte diszulfidokhoz vezet A reakció megfordítható, így redukálószerek (pl. Zn + HCl) hatására visszanyerhető a tiol 4 Erélyes oxidálószerek (pl. persavak, KMnO4 stb) hatására a tiolok szulfonsavvá alakíthatók A szulfonsavak vízben oldódó erős savak, az aromás származékokat bőrcserző anyagként használják. Tiolok előállítása Alkil-halogenidekből Na- vagy K-hidrogénszulfiddal, alkalmazni, a további alkilezések elkerülése végett. amit feleslegben kell Tiokarbamidból S-alkilezéssel, majd lúgos hidrolízissel (ebben az esetben nem képződnek melléktermékek): Reakciók 5 Fontosabb tiolok Etántiol: színtelen, nagy higításban is kellemetlen szagú folyadék. Forráspontja 35 °C Vízben rosszul, alkoholban jól oldódik. Világszerte
egyezményesen az eredetileg teljesen szagtalan földgáz szagosítására használják. A szaga mindenkinek gyakorlatilag egyet jelent a gáz jelenlétének feltételezésével, ami igen hasznos figyelmeztetés, lévén a fölgáz az ember számára máshogy nem lenne érzékelhető. A szag-inger már jóval a robbanásveszélyes koncentráció kialakulása előtt kellemetlenné és figyelemfelkeltővé erősödik, ezáltal megelőzhetővé téve egy esetleges katasztrófát. Szulfonsavszármazékok Jelentősek a szulfonsav-kloridok (ld. alkánok, benzol reakciói), melyek sok irányba alakíthatók át. A szulfonamidok fontos gyógyszerek (Ultraszeptil, Szulfaguanidin) 6 R N H2N SO2 HN N R' Szulfaguanidin (R, R' = H, Me) Szuperszeptil (R,R' = Me) SO2Cl SO2NHR H 2O RNH2 szulfonamid ROH H2 /kat. SH tiol SO2OH szulfonsav SO2OR szulfonsav-észter A benzolszulfonil-klorid átalakításának lehetőségei: A toluol klórszulfonálásával nyerhető
szulfonsavszármazékok mesterséges édesítőszerek (szacharin) ill. fertőtlenítőszerek (Diklóramin-T) 7 2 mol ClSO3H SO2Cl NH3 SO2NH2 SO2NH2 NH3 ox. SO2Cl SO2NH2 NaOCl OH O SO2NCl2 S O O S NaOH N Na Diklóramin-T O - H2O O NH O O szacharin-Na só (oldódik vízben) szacharin Nitrovegyületek Nitrovegyületek levezetése: O HO HO N N O O salétromsav salétromossav O R N O R O nitrovegyület (nitroalkán) Nitrocsoport szerkezete: O R N N O R O N O O salétromsav-észter (alkil-nitrát) nitrozovegyület (nitrozoalkán) salétromossav-észter (alkil-nitrit) 8 Elnevezés Csak szubsztitúciós nomenklatúra Nitro-, nitrozo előtag + alapvegyület O2N NO CH3NO2 nitrometán nitrozobenzol Előállítás: NO2 NO2 1,3-dinitrobenzol (preferált) o-dinitrobenzol 2-nitronaftalin Alifás vegyületek: lásd alkánok Aromás vegyületek: elektrofil szubsztitúcióval 1. NO2 NO2 HNO3 H2SO4 60 °C füstölgő HNO3 H2SO4 100 °C
NO2 NO2BF4 NO2 FSO2OH O2N NO2 2. A trinitrotoluol (más néven trotil vagy TNT) gyakran használt robbanóanyag. A toluol nitrálásával állítható elő (ld. fent) Fizikai tulajdonságok A nitrovegyületek forráspontja és olvadáspontja – a nitrocsoport jelentős dipólus momentuma következtében kialakuló erős dipól-dipól kölcsönhatásai miatt – jóval magasabb a megfelelő szénhidrogénekéhez és azok más monoszubsztituált származékaihoz képest. A nitroparaffinok színtelen, jellegzetes illatú, általában bomlás nélkül desztillálható vegyületek. Vízben alig, vagy egyáltalán nem oldódnak, viszont lúgban oldódnak és többnyire szerves oldószerekkel is jól elegyednek. A mononitro-származékok általában színtelenek, a több nitrocsoportot tartalmazó származékok sárga színűek. 9 Az aromás nitrovegyületek többsége szobahőmérsékleten szilárd, kristályos anyag – kivétel a nitrobenzol, mely folyadék, forráspontja 207
C. A nitrocsoportok számával az olvadáspont általában nő. Vízben alig, tömény salétromsavban és számos szerves oldószerben viszont jól oldódnak. Nitro-acinitro tautoméria: a nitro csoporttal szomszédos C-H kötés lazított, a nitro csoport erősen elektronszívó. Redukció Az alifás és aromás nitrovegyületek hasonló reakciókat szenvednek. A redukció esetén azonban különbözően viselkednek, aszerint, hogy alifás vagy aromás szénlánc kapcsolódik a nitro csoporthoz. Általános redukciós folyamat: A termék szerkezete a redukáló ágens, valamint a közeg pH-jától függ. Katalitikus hidrogénezés Redukció fémek jelenlétében, savas közegben: Fe, Sn, Zn / HCl (Béchamp redukció) 10 Redukció semleges közegben: Zn por / ammónium-kloriddal, hidroxil-amin keletkezik A hidroxil-aminok ammóniás ezüst-nitráttal (Tollens reagens) melegítve, nitrozoszármazékokká alakulnak, és ezüsttükörré redukálják a Tollens reagenst
(BakerMulliken teszt, a nitrovegyületek kimutatására). Redukció bázikus közegben A redukáló ágenstől függően a nitrobenzol különböző termékekké alakul. 11 Redukció LiAlH4-el Az alifás nitrovegyületek primer aminokká alakulnak. Az aromás nitrovegyületek azoszármazékokat adnak. Trinitrotoluol A nagy tisztaságú TNT halványsárga színű, levegőn lassan barnuló, kristályos vegyület. Vízben gyakorlatilag nem oldódik, azonban szerves oldószerek (aceton, metilén-klorid, toluol) kiválóan oldják. A TNT kitűnő, igen alacsony ütésérzékenységű, közepes hatóerejű kémiai robbanóanyag. Még az első világháború alatt terjedt el és akkora népszerűségre tett szert, hogy ezt az anyagot választották mind a kémiai, mind a nukleáris robbanás erejének viszonyítási alapjául. Előállítás Toxicitás és környezeti ártalmak A TNT erősen mérgező vegyület. Bőrrel való érintkezéskor sárgás elszíneződés és erős
irritáció léphet fel. A második világháború alatt, azok a hadianyag munkások, akik érintkezésbe kerültek vele és besárgult tőle a bőrük, a "kanári" gúnynevet kapták. Hosszú idejű expozíció esetén vérszegénység, elégtelen májfunkció, lép megnagyobbodás és egyéb immunrendszeri károk alakulnak ki. Továbbá tény, hogy a férfiaknál hátrányosan befolyásolja a nemzőképességet, és, mint lehetséges rákkeltő van nyilvántartva. A trotil elfogyasztásakor a vizelet piros árnyalatúvá válik, amit annak metabolitjai okoznak, és nem vér, mint azt korábban hitték. Némely katonai gyakorló területeken a felső talajréteg kimutathatóan szennyeződött trotillal. A talajvíz ennek köszönhetően pedig rózsaszínűvé vált Az utólagos mentesítés drága és komplikált művelet. Alkalmazásai 12 A TNT az egyik legnagyobb mennyiségben alkalmazott ipari és katonai robbanóanyag. Óriási előnye az igen alacsony ütés- és
dörzsérzékenysége, ami jelentősen csökkenti alkalmazásának kockázatát. Kristályai 80 °C-on megolvadnak, ezzel könnyen töltényezhető, formába önthető és keverhető egyéb robbanóanyagokkal. Bomlása és spontán detonációja csak jóval e hőmérséklet felett következik be. A TNT nem higroszkópos és nem is oldódik vízben, ezért ebből a szempontból gond nélkül tárolható nedves környezetben. Stabilitása is kiváló a többi brizáns robbanóanyaggal való összehasonlításban. Robbanása mértékét a képződő gázok nagy feszítő ereje okozza (H, N, CO2). Dinamit és TNT Közkeletű tévedés, hogy a dinamit és a TNT egy és ugyanaz. Valójában, amíg a TNT egy önálló kémiai vegyület, addig a dinamit egy keverék, amely többnyire nitroglicerinből és flegmatizátorból (leginkább kovaföldből) áll. Aminok Természetes vegyületek 13 Foltos bürök kávécserje dohány Conium maculatum Coffea arabica Nicotiana tabacum Mák
Légyölő galóca Nadragulya Papaver somniferum Amanita muscaria Atropa belladonna Elnevezés RNH2, RR’NH, RR’R”N típusú vegyületek Primer aminok a.) RH alapvegyület + amin (főcsoportot jelölő utótag), (szubsztitúciós művelet) b.) R-csoport + kötőjel + amin funkciós csoportnév (csoportfunkciós nomenklatúra) 4 NH2 5 3 O 4 NH2 2 benzofurán-2-amin (benzofurán-2-il)-amin 3 N 4 2 2 N 1 a.) propánamin b.) propil-amin NH2 3 1 1 kinolin-3-amin (kinolin-3-il)-amin HOOC 4-aminobenzoesav Szekunder és tercier aminok NH2 2 1 5 imidazol-4-metánamin (imidazol-4-ilmetil)-amin Ha az NH2- nem főcsoport, akkor „amino” előtagként használjuk: HO NH NH2 3 4 NH2 3-aminobutanol 14 Szimmetrikus aminok: R2NH, R3N b.) „di” vagy „tri” + csoport neve + kötőjel + amin funkciós csoportnév NH (CH3CH2)3N (ClCH2CH2)2NH difenil-amin trietil-amin bisz(2-klóretil)-amin Aszimmetrikus aminok: RR’NH, R2NR’, RNR’R” a.) az
alap primer amin N-szubsztituált származéka b.) R, R’, R” csoportok (megfelelő sokszorozó taggal ellátva, egymástól kötőjellel elválasztva, betűrendbe sorolva) + kötőjel +amin funkciós csoportnév Cl NH N N C6H5 a.) N-(2-klóretil)propán-1-amin b.) (2-klóretil)-propil-amin N-etil-N-metilbután-1-amin butil-etil-metil-amin N-etil-N-propilanilin etil-fenil-propil-amin Kötésrendszer Az aminok szerkezetét a nitrogénatom sp3 hibridizációjának megfelelő trigonális piramisos geometria jellemzi, az N–C vegyértékszögek értéke pedig közelítőleg 108. Az ammóniából vezethetők le, a hidrogén atomok szénláncra való cseréjével. 15 Fizikai sajátságok Az aminoknak (akárcsak az alkoholoknak) sokkal magasabb a forráspontjuk, mint a hasonló molekulatömegű szénhidrogéneknek. A kis szénatomszámú aminok poláris jellegükből adódóan egymással dipol–dipol kölcsönhatásba lépnek, illetőleg hidrogénkötéseket képeznek.
Ezek – a szénhidrogénekre nem jellemző – intermolekuláris kölcsönhatások okozzák a szénhidrogénektől jelentősen eltérő fizikai tulajdonságokat. Az intermolekuláris hidrogénhíd kötődések az aminokban gyengébbek, mint az alkoholokban. (nitrogén kisebb méretű, a vegyérték elektronok és a nemkötő pár nagyobb magvonzás alatt állnak). R1 R1 N H R2 N H amin R H O H R2 O R alkohol Az alacsonyabb szénatomszámú aminok vízben jól oldódnak (jobban, mint az alkoholok és az éterek, mert a nitrogénatom jobb protonakceptor, mint az oxigén), a nagyobb szénatomszámúak (pl. az aromás aminok) esetében a szénhidrogén-maradékok hidrofób jellege kerül túlsúlyba és ezért az oldhatósága romlik. Az aminok szerves oldószerekben jól oldódnak. A kvaterner ammónium vegyületek és a különböző rendű aminok ammóniumsói ionos szerkezetük révén vízben általában jól, szerves oldószerekben kevésbé vagy egyáltalán nem
oldódnak. Az aminok kellemetlen szagú vegyületek (pl a bomló hal szaga származik aminokból). A szagra való utalás sok esetben az amin nevében is tükröződik A bután-1,4diamin triviális neve: putreszcin (putresco: megrothad), a bután-1,5-diamin triviális neve: kadaverin (cadaver: hulla). Az aminok bázicitása Gázfázisban szolvatáció hiányában a bázicitást a szubsztituensek elektronos hatása határozza meg. Elektronküldő csoportok növelik a nitrogénatom elektronsűrűségét és így a bázicitást is Bázicitás növekvő sorrendje gázfázisban: (CH3)3N > (CH3)2NH > CH3NH2 > NH3 Oldat fázisban – így vízben is – mindezen túl a dipol–dipol kölcsönhatás és hidrogénkötés hatása is érvényesül. 16 H H3C N dipól-dipól kölcsönhatás H HO H H X H3C N H X H hidrogénkötés H H O H Vizes közegben az alkilcsoportnak kettős hatása van az ammóniumionra. Egyrészt elektronküldő sajátsága révén
elősegíti a töltésdiszpergálódást, s így az iont stabilizálja, másrészt nehezíti az oldószermolekula hozzáférését, azaz a szolvatációt. E két hatás eredője alakítja ki az adott amin bázicitását. Az ammóniumion egyetlen hidrogénjének metilcsoportra történő cseréje közelítőleg egy egész egységgel növeli a bázicitást. A második hidrogénnek a cseréjekor azonban a bázicitás már nem változik, mivel a stabilizáló és destabilizáló hatás kiegyenlíti egymást. A harmadik hidrogénatom cseréje után viszont – a szolvatáció csökkenése miatt – a destabilizáló hatás kerül túlsúlyba. Így a legerősebb bázisok a szekunder aminok. Bázicitás növekvő sorrendje vízben: Az anilin kisebb bázicitásának oka: a nitrogén nemkötő elektronpárjának az aromás rendszerrel való konjugációs kölcsönhatása. Ezt elektronszívó szubsztituensek még jobban csökkentik. Kémiai tulajdonságok Alkilezés: vegyes termékek, nem
kedvező módszer, elválasztást igényel. 17 Mechanizmus: Acilezés: védőcsoport, savkloridok, savanhidridek, szulfonsav-kloridok alkalmazásával Hinsberg próba: aminok elválasztása, rendűség alapján. 18 Aminok reakciója salétromossavval Primer aminok Szekunder aminok A nitrozoaminok erősen mérgező, rákkeltő vegyületek! Tercier aminok Aromás primer aminok Aromás szekunder aminok Aromás tercier aminok 19 Reakció oxovegyületekkel Leválasztásra használható: a primer aminok imineket képeznek Mechanizmus: A szekunder aminok enaminokká alakulnak. Mechanizmus: Eliminációs reakciók A kvaterner ammónium-sók ezüst-oxid jelenlétében, melegítés hatására eliminációs reakcióba lépnek, és alkének keletkeznek. (Hofmann elimináció) 20 Mechanizmus: Szelektivitás Ismeretes, hogy az E2 reakciók sztereokémiai feltétele a H-C kötés és C-LG kötés antiperiplanáris állása (180o). Ez a konformáció biztosítja a
felhasadó kötések megfelelő helyzetét a kötés kialakulásához. Az előző ammónium-só lehetséges konformációi és energia viszonyaik: 21 A konformerek energiatartalmából látható, hogy csak a láncvégi alkén képződése kedvező. A Hofmann szabály szerint a hidrogén a kevésbé szubsztituált szénatomról lép ki. Diazóniumsók átalakításai: Sandmeyer reakció, Gatterman reakció (réz-sók jelenlétében), NaBF4-dal Schiemann reakció. 22 Azokapcsolási reakciók Diazovegyületek Általános képlet: R2C=N2 Az elektron szerkezetük a következő rezonancia formákkal írható le: A legstabiabb származékok az α-diazoketonok és α-diazoészterek, mert ezek esetében a negative töltés megoszlik a karbonil csoporton. A legtöbb diazovegyület heves robbanószer 23 Kereskedelmileg is hozzáférhető vegyület az etil-diazoacetát (N2CHCOOEt). Hasonló tulajdonságúak a gyűrűs származékok, a diazirinek. Diazometán: metilezőszer,
semleges közegben (gáz, fp. -23ºC, éterben nyeletve használják) Azovegyületek felhasználása Az aromás azovegyületeket a textiliparban színezékként, az analitikai kémiában pedig savbázis indikátorként alkalmazzák. A vegyületek színe molekuláik -elektronrendszerének könnyű gerjeszthetőségével függ össze, azaz már a látható fény is gerjeszteni tudja a HOMO pályán levő elektronjaikat. Az azocsoport protonálódásával azonban megváltozik a gerjesztési energia, ezáltal a protonált és nemprotonált formák színe is különbözik. Ezen a jelenségen alapul indikátor szerepük. O O S O CH3 N N N O S CH3 O CH3 N N N CH3 O sárga (lúgban) pH > 4,0 max = 454 nm +H O O S O H N N -H O CH3 O S N CH3 metilnarancs O H N N CH3 N CH3 piros (savban) pH < 3,1 max = 504 nm A metilnarancs indikátor színváltozása természetesen független a szulfonsav protonáltsági fokától. Azt csak az azocsoport – mint
kromoforcsoport – nitrogénjének protonálódása, illetve deprotonálódása határozza meg. Aminok előállítása Primer aminok: 24 Szekunder és tercier aminok: 25 Aldehidek és ketonok Természetes vegyületek Fahéj Cinnamonum verum Citromfű Cymbopogon marginatus Szibériai pézsmaszarvas Moschus moschiferus vanilia Vanilla planifolia Konyhai kömény Carum carvi Kámforfa Cinnamomum camphora 26 Kötésrendszer, szerkezet A karbonilcsoport, C=O Formaldehid C: 1s22s22px12py1 Oxigén: 1s22s22px22py12pz1. Kötési energia A kötési energia értékéből az adódik, hogy a kettős kötés kialakulása egyes reakcióknál hajtóerő lehet, mivel energetikailag kedvező. A C=O kettős kötés kötési energiája nagyobb mind a C-O egyszeres kötés energiájának kétszerese. 27 Polaritás Tekintettel a töltésszétválásra, a nukleofil addíciók jellemzők. Aldehidek nevezéktana Általános képlet: C C O H a.) ha a megfelelő karbonsavnak
triviális neve van, a sav latin szótöve + aldehid b.) aciklusos mono és dialdehidek: azonos szén atomszámú szénhidrogén neve + al, dial c.) más aldehidek: alapnév + karbaldehid utótag Előtag: „formil” CH3CHO 3 4 CHO OHC CHO 2 a.) acetaldehid b.) etanal c.) OHC 1 3 pentanal 2 1 CHO pentándial OHC 3 CHO b.) c.) bután-1,2,4-trikarbaldehid 2 CHO ciklohexánkarbaldehid 1 CHO CHO 2-(formilmetil)hexándial Ketonok nevezéktana Általános képlet: C C C O a.) szubsztitúciós név: alapnév + „on”, „dion”, stb utótag előtag: „oxo” b.) csoportfunkciós név (mono- és vicinális diketonok esetében): R,R’ csoportnevek betűrendben, kötőjellel elválasztva, + kötőjel + keton/diketon utótag 28 O O a.) bután-2-on b.) etil-metil-keton heptán-2-on metil-pentil-keton O O O O 1-fenilpentán-2,3-dion benzil-etil-diketon COOH O a.) heptán-2,4-dion 4-oxociklohexánkarbonsav N H O piridin-2(H)-on Aromás ketonok
esetében: „ofenon”, „onafton” utótag is használható O O a.) 1-feniletanon b.) fenil-metil-keton acetofenon difenilmetanon difenilketon benzofenon O 1-fenilpropanon etil-fenil-keton propiofenon O 1-naftiletanon metil-naftil-keton acetonafton Aldehidek és ketonok fizikai tulajdonságai A legegyszerűbb oxovegyület a formaldehid gáz-halmazállapotú, de a legtöbb aldehid és keton jellegzetes illatú folyadék. Forráspontjuk a karbonilcsoport polározottsága miatt kialakuló dipol–dipol kölcsönhatásoknak köszönhetően magasabb, mint az azonos móltömegű szénhidrogéneké, de alacsonyabb, mint az alkoholoké. A kisebb szénatomszámú vegyületek vízben korlátlanul oldódnak, a szénlánc növekedésével az oldékonyság csökken. Szerves oldószerekben általában jól oldódnak. Kémiai tulajdonságok Nukleofil addíciós reakciók: a karbonil szénen 29 Reakció az -helyzetű szénen: a proton lazított, tekintettel a karbonil csoport
elektronszívó tulajdonságára A reaktivitást befolyásoló tényezők: Reverzibilis reakciók Reakció oxigén-nukleofilekkel Kivétel: klorál (Neve a klór és az aldehid szavak összevonásából ered). A három klóratom elektronszívó hatása miatt, a víz könnyen addícionálódik. 30 Fizikai és kémiai tulajdonságok Színtelen, szúrós szagú folyadék. Sűrűsége 1,51 g/cm3 Olvadáspontja -57,5°C Forráspontja 97,8°C Vízzel reakcióba lépve klorál-hidrát keletkezik Előállítás Etanol klórozásával Felhasználás A klorál-hidrát nyugtató hatású, régen nyugtatószernek alkalmazták. A DDT gyártásának egyik kiindulóanyaga volt. Acetálképzés aldehidekből: védőcsoport 31 Reakció nitrogén-nukleofilekkel imin (Schiff bázis) Mechanizmus: Enaminok: Mechanizmus: Néhány, leválasztásra alkalmas reakció: 32 Reakció szén-nukleofilekkel Hidrogén-cianid addíció Ireverzibilis reakciók Az oxovegyületek redukciója
Katalitikus hidrogénezés 33 Redukció fémhidridekkel: lítium-alumínium-hidrid, nátrium-tetrahidrido-borát Mechanizmus: Az oxovegyületek oxidációja Krómsavval: szekunder alkoholok esetén, ketonok képződnek, a primer alkoholok karbonsavvá oxidálódnak. Piridinium-kloro-kromáttal: primer alkoholok esetén, aldehidekké. 34 Oxidációs lehetőségek: Mechanizmus: Reakció fémorganikus vegyületekkel Laboratóriumban gyakran alkalmazott módszer alkoholok előállítására. Mechanizmus: 35 Enol-oxo tautoméria Szerkezeti izoméria: egy proton és egy kettős kötés vándorlása Sav katalízis: Bázis katalízis: 36 Az oxovegyületek-szénatomján lejátszódó reakciók Előzményük: a keto-enol tautoméria -Hidrogén savassága: pKa = 19 pKa = 17 A ketonokban több alkil csoport van, amelyek elektronküldő tulajdonságúak, ezért a keton enolátja kevésbé stabil. Enolátok reakciói: Michael addíció: 37 Mechanizmus:
Haloform reakció Halogénezés: sav- vagy bázis katalízis alatt megy végbe Mechanizmus: sav katalízis 38 Bázis katalízis: Aldol reakció Bázis katalízis Sav katalízis: 39 Az aldolok dehidratálhatók, ,-telítetlen aldehidekké. Oxovegyületek kimutatási reakciói Az aldehidek kimutathatók ezüsttükör (ammoniás ezüst-oxid – Tollens)- vagy Fehling-próbával (réz-szulfát + Na,K-tartarát + NaOH oldat) Tollens teszt 40 Fehling teszt Karbonsavak Szerkezet A delokalizáció (stabilabb rendszer) miatt a karbonsavak mért energia tartalma 24 kcal/mól értékkel kisebb, mind a számított érték (konjugációs vagy stabilizációs energia). A delokalizáció léttrejöttét bizonyítja a kötéstávolságok értéke is. A karboxilcsoportban a karbonilcsoport kötéshossza nagyobb, mint mint az aldehidekben, a C-O kötés azonban rövidebb, mint az alkoholokban. A határszerkezetekből látszik, hogy az elektron delokalizáció nem teljes, a
karbonil oxigénen nagyobb az elektron sűrűség, az O-H kötésben levő elektronok az oxigén atomtörzshöz 41 húzódnak, ezért a proton lehasadása könnyen bekövetkezhet. Ezért a karbonsavak erősebb savak, mint pl. az alkoholok, ahol a konjugáció nem következhet be A karboxilát anion: stabil, szimmetrikus delokalizációju, képződése hajtóerő. Elnevezés Aciklusos mono és dikarbonsavak: szénhidrogén neve + sav, disav utótag COOH hexánsav HOOC COOH hexándisav COOH hex-4-énsav 42 Ha több karboxilcsoport kapcsolódik közvetlenül a nem elágazó lánchoz: szénhidrogén neve + kötőjel + sokszorozó előtaggal karbonsav utótag COOH HOOC COOH bután-1,2,4-trikarbonsav Ha gyűrűs az alapvegyület: alapnév + karbonsav utótag COOH ciklohexánkarbonsav Előtag: „karboxi” COOH N COOH Cl HOOC COOH CH3 (3-karboxi-1-metilpiridinium)-klorid 3-(karboximetil)heptándisav Karbonsavak sói Kation neve + kötőjel + alapnév + oát (sav
utótag helyett „oát” = anion) COO K (CH3COO - )2Ca2+ K OOC káluim-butanoát kalcium-diacetát kálium-nátrium-szukcinát COO Na Karbonsavak nevének eredete Néva Származásb Megjegyzés Adipinsav L, adeps, zsír Telítetlen zsírok oxidációjakor keletkezik. Almasav Először éretlen almából állították elő. Benzoesav Egy Indonéziában honos fa gyantájából, a benzoegyantából állították elő. Borkõsav Borkészítéskor "borkő" alakjában válik ki (a borkõ, latinul tartarus, kálium-hidrogén-tartarát). Borostyánkõsav A borostyán desztillációs bontásakor képzödő 43 desztillátumban fedezték fel. Ecetsav Fumársav Az ecetben található. L, fumus, füst A Fumaria nevű növényben található; a növényt régen azért égették, hogy a füstjével elűzzék a gonosz szellemeket. Hangyasav Hangyák desztillációs bontásával állították elő. Glutársav Először a glutaminsavból állították elő.
Kapronsav L, caper, kecse Kecsketejben található, szaga a kecskére emlékeztet. Linolsav, lenolajsav G, linon, len + olaj Glicerin-észter formájában megtalálható a lenolajban. Maleinsav L, malum, alma Az almasav dehidratációs terméke. Malonsav L, malum, alma Először az almasav oxidációjával állították elő. Oxálsav G, oxisz, savanyú Savanyú ízű vegyület, az Oxalis nemzetséghez tartozó növényekből vonható ki. Palmintisav L, palma, pálma Megtalálható a pálmaolaj gilcerin-észterében. Piroszõlõsav G, piro, tûz A (szőlőből kiváló) borkősav pirolízisével állítható elő. Propionsav G, proto, elsõ és pion, zsír A legrövidebb szénláncú sav, amely a hosszabb zsírsavak tulajdonságait mutatja. Sztearinsav G, sztear, faggyú Növényi és állati zsírok glicerin-észtereiben fordul elő. Tejsav Aludttejben fedezték fel. Vajsav Avas vajban található. Valeriánsav, macsakgyökérolaj A Valeriana officialis
(macskagyökér) gyökeréből nyerik ki. (A macskákra ingerlően hat a növény fő alkaloidja.) a G: görög, L: latin Fizikai tulajdonságok a forráspont magasabb, mint a megfelelő alkoholokké, ok: dimer képződés, hidrogénkötések révén. 44 Vízoldhatóság: Kémiai tulajdonságok: átalakítási lehetőségek A karbonsavak savi jellege: Szubsztituált karbonsavak savi erőssége: 45 A karbonsavak dekarboxilezése: Szerkezettől függ: elektronszívó csoportok kedveznek a folyamatnak Mechanizmus: Dikarbonsavak hevítése: hosszabb lánc esetén anhidridek képződnek 46 Karbonsavak reakciói Karbonsavak átalakítása savkloridokká: különböző reagensekkel lehetséges, de nem hidrogén halogenidekkel. Fontos, mert az összes többi karbonsavszármazék előállítható savkloridokból Mechanizmus: nukleofil szubsztitúció 47 Észterképzés savkatalízis, egyensúly reakció 48 semleges közegben, diazometánnal A
karbonsavak halogénezése -helyzetben: Hell-Volhard-Zelinsky reakció Mechanizmus: 49 Az -halogénezett savak reakciókészsége Karbonsavak kimutatási reakciói pH mérés: 5% ecetsav oldat, pH papír Nátrium-bikarbonát teszt CO2 fejlődés pozitív teszt Zsírsavak A kémiában zsírsavaknak hívjuk azokat a (mono)karbonsavakat, melyek hosszabb (legalább 8 – egyes kémikusok szerint 4 – szénatom hosszúságú), telített vagy telítetlen alifás láncot tartalmaznak. A természetben előforduló zsírsavak általában páros számú szénatomból épülnek föl, ugyanis a bioszintézisük a 2 szénatomos acetát-csoportokból (ecetsav) történik. A zsírok és zsírszerű anyagok (olajok) annyira elterjedtek a növényvilágban, hogyha csekély mennyiségben is, de majdnem minden növényi alkatrészben feltalálhatók. A növények egyes részei és pedig leggyakrabban a magvak, súlyuknak mintegy felét kitevô magas zsírtartalommal bírhatnak. Az
állatvilágban a növényvilághoz hasonlóan szintén igen elterjedtek az olaj- és zsírféleségek. Sokszor vastag rétegekben, laza sejtek közé ágyazva, vagy bôr alá rétegezve, mint "szalonna", a hasüregben, mint "háj", a szárcsontokban és koponyaüregben, mint "velô" vannak felhalmozva. Egyes rovarok, pl a méhek testükbôl nagy mennyiségû zsírt (viaszt) választanak ki. A tengerekben élô állatok, nevezetesen a bálnák és rozmárfajták teste különösen zsírdús. Az előfordulásnak megfelelôen a növényi zsíroknál a magokat és a terméseket, míg az állatoknál a zsírszöveteket, melyek a zsírt magukba foglalják (szalonna, háj, csontzsír, velô), dolgozzák fel zsírkinyerés céljaira. A zsírsavak a glicerinnel triglicerideket alkotva képezik a természetes zsírokat és olajokat. 50 A zsírsavak redukciójával kaphatjuk a zsíraldehideket illetve a zsíralkoholokat. Telített Képlet Triviális név
Olvadáspont CH3(CH2)10CO2H laurinsav 45 ºC CH3(CH2)12CO2H mirisztinsab 55 ºC CH3(CH2)14CO2H palmitinsav 63 ºC CH3(CH2)16CO2H sztearinsav 69 ºC CH3(CH2)18CO2H arachidinsav 76 ºC Telítetlen Képlet Triviális név Olvadáspont CH3(CH2)5CH=CH(CH2)7CO2H palmitoleinsav 0 ºC CH3(CH2)7CH=CH(CH2)7CO2H olajsav 13 ºC CH3(CH2)4CH=CHCH2CH=CH(CH2)7CO2H linolsav -5 ºC CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7CO2H linoleinsav -11 ºC CH3(CH2)4(CH=CHCH2)4(CH2)2CO2H arachidonsav -49 ºC A zsírok és olajok fôalkatrészei közül a keményebb zsírokban (pl. disznózsírban és még inkább a faggyúban) inkább a sztearinsavas és palmitinsavas glicerinészter, a folyékony zsírokban – vagyis olajokban – fôként az olajsavas glicerinészter dominál. Étkezésre szolgáló olajok és zsírok kinyerése és elôkészítése természetesen különös eljárásokat, gondos munkálatokat igényel, mert ezeknek az olajoknak a higiénia követelményeinek is
eleget kell tenni. Itt említjük meg, hogy a legáltalánosabban használt étolaj a hideg, vagy csak a gyengén melegpréselésű olivaolaj, melynek savmentesnek és szagtalannak kell lenni. Étolajul azonban jól felhasználható a szezámolaj, nemkülönben a tökmagolaj, a napraforgóolaj és a kendermagolaj is. 51 A mesterséges ételzsírok közül külföldön nagy szerepet játszik a művaj vagy más néven margarin. Margarin gyártására marhafaggyút szokás használni, melyből sajtolással mindenekelőtt oleomargarint készítenek. Oleomargarin alatt a faggyúnak 30–32 Co között még folyékony részét értjük. A présből kifolyó oleomargarin megdermedés után fehér, legfeljebb gyengén sárgás tömeget alkot, mi ételek készítésére közvetlenül is felhasználható. Hogy ebből vajszerű tömeget nyerjünk, még további eljárásnak kell alávetni, melyet vajasításnak neveznek. Ez lényegileg abban áll, hogy az oleomargarint tejjel dolgozzák el,
miközben a vajszerű állomány biztosítására más zsírokat (szezámolajat, kókuszolajat, gyapotmagolajat stb.) is adnak hozzá Jó minőségű margarinvaj pl a következő anyagokból készül: Nyári készítmény Téli készítmény Teljes tej 500 l 500 l Oleomargarin 500 kg 500 kg Faggyú 25 kg – Szezámolaj 50 kg 70 kg Dán vajfesték 0,40 kg 0,40 kg A zsírok és olajok technikai feldolgozásának legősibb módja az, hogy belőlük szappant főzünk. A képződő nátronszappan nem egyéb, mint a zsírokban foglalt zsírsavak nátriumsójának keveréke. Az egyidejüleg felszabaduló glicerin a házi szappanfőzésnél veszendőbe megy. Szappanok és detergensek 52 A felületaktív anyagok mosóhatása A tenzidek vízben oldható anyagok. A homogén elegy (oldat) kialakulásának előfeltétele a mosásnak (mosogatásnak, mosdásnak), ami nem más, mint a szennyeződések eltávolítása a tisztítandó felületről felületaktív anyag
tartalmú készítmény és sok víz segítségével. A tenzideknek e folyamatban kifejtett tevékenységét nevezzük mosóhatásnak. Ez többféle, egyidejűleg lejátszódó részfolyamat eredményeképpen valósul meg. Elsőként a felületaktív anyagok közrefogják a szennyeződést (és a mosandó textíliát), azaz nedvesítenek. Erősebb kapcsolatot képesek létesíteni a szennyeződéssel és a textíliával, mint a szennyeződés a textíliával, ezért e két anyag közé is beékelődnek. A szennyeződést így lefejtik és kisebb molekulahalmazokra bontják, aprítják, idegen szóval: diszpergálják. Ez a részfolyamat annál gyorsabban zajlik le, minél nagyobb felületen terül el ugyanaz a szennyeződésmennyiség, valamint minél frissebben került az a textíliára. A felületaktív anyagok diszpergáló hatása A rászáradt, régi, erősen kötődő, nagy mennyiségű szennyeződés fellazítása csak hosszas áztatás során valósítható meg. A
fellazított, leválasztott, szétdarabolt folyékony szennyeződés kis gömböcskék alakjába húzódik össze, amiket természetesen körülvesznek a felületaktív anyag molekulái és az e körül lévő vízmolekulák, a hidrátburok. A szilárd szennyeződést hasonló módon darabolja, leválasztja és eltávolítja a textil szálaitól. Ez a kettős gyűrű biztosítja a szennyeződés tökéletes emulgeálását. Az emulgeáló hatás (azaz a kettős elektromos burok) gátolja meg azt, hogy a szennyeződés újra visszatapadhasson a mosólében lévő textilneműre. 53 A felületaktív anyagok emulgeáló hatása a) a szennyeződés eloszlatása; b) a szennyeződés visszajutásának megakadályozása Viaszok spermaceti méhviasz karnauba viasz CH3(CH2)14CO2-(CH2)15CH3 CH3(CH2)24CO2-(CH2)29CH3 CH3(CH2)30CO2-(CH2)33CH3 Ámbrás cet (Physeter macrocephalus) prunifera) Házi méh (Apis mellifica L.) Carnauba pálma (Copernicia A nagy molekulasúlyú zsírsavaknak
nagy molekulasúlyú egyértékű alkoholokkal képezett észterei a viaszok, melyek szagtalan szilárd anyagok, s külsőleg a paraffinra emlékeztetnek. Kémiailag azonban lényegesen különböznek a paraffinektől, mert elszappanosíthatók, vagyis vízfelvétellel savra és alkoholra bonthatók fel, míg a paraffinek szénhidrogének lévén, nem bomlanak. A viaszok állati és növényi szervezetek anyagcseretermékeiként fordulnak elő a természetben, kisebb-nagyobb mértékben más anyagokkal (pl. szénhidrogénekkel, szabad savakkal) szennyezve. A legközönségesebb viasz a méhviasz, mely főtömegében a palmitinsavnak miricilalkohollal képezett észteréből, C15H31COOC30H61, áll. Természetes állapotában sárga színű, 63–65 Coon olvadó viasz, mely gyakran fehérített állapotban kerül forgalomba (sárga és fehér viasz) Különböző ipari célokra, s az orvosi gyakorlatban kenőcsök alapanyagául használják. A bőrgyógyászatban előszeretettel
használják a bálnaviaszt vagy cetaceumot (spermacet-et), mely a bálna-félék koponyaüregében található. Ez az 50 Co-on olvadó kristálylemezkékből 54 álló viasz főleg a palmitinsav cetilalkohollal képezett észteréből, C15H31COOC16H33, áll. A kínai viasz rovaroknak az anyagcsereterméke és cerotinsavas cerilészterbôl áll, C25H51COOC26H53. Az állati eredetű viaszok közül említésre méltó még a gyapjúzsír (lanolin), mely a gyapjún keletkezik és a gyógyszerészetben, valamint a kozmetikában játszik fontos szerepet. A carnauba-viasz viszont, melyet pl. paraffingyertyák fehérítésére használnak, növényi eredetű és fő alkotórésze a cerotinsavas miricilészter, C25H51COOC30H61. Karbonsavszármazékok Levezetés, általános képlet Kémiai rokonság Származékok Savhalogenidek: 55 a.) csoportfunkciós név: acilcsoport + kötőjel +halogenidek neve betűrendben b.) funkciós csoport módosítását jelző név: sav neve +
kötőjel + halogenid neve O Br Br Cl H3C Cl O O a.) acetil-klorid b.) ecetsav-klorid O hexanoil-bromid hexánsav-bromid Cl O malonil-bromid-klorid malonsav-bromid-klorid Előtag: „halogénkarbonil” O Cl tereftaloil-diklorid tereftálsav-diklorid O O Cl OH O Cl O O klórkarbonilecetsav etil-[2-(klórkarbonil)benzoát] Anhidridek Szimmetrikus anhidridek: sav neve + kötőjel + anhidrid funkciós csoportnév O O O O O O ecetsav-anhidrid Gyűrűs anhidridek: O O hexánsav-anhidrid O ciklohexánkarbonsav-anhidrid a.) szimmetrikus anhidridként b.) heterociklusként O O O O a.) borostyánkõsav-anhidrid (butándisav-anhidrid) b.) tetrahidrofurán-2,5-dion O O O O glutársavanhidrid pentándisav-anhidrid tetrahidropirán-2,6-dion O ftálsav-anhidrid 1,3-dihidroizobenzofurán-1,3-dion Aszimmetrikus (vegyes) anhidridek: a két sav betűrendben, kötőjellel elválasztva + kötőjel + anhidrid 56 O O O O O O butánsav-propánsav-anhidrid O O Cl O
ecetsav-klórecetsav-anhidrid benzoesav-propánsav-anhidrid Előtag: „aciloxikarbonil” H3C O O CH2 O OH O acetiloxikarbonilecetsav Észterek Alkil és/vagy aril csoportnév betűrendben felsorolva + kötőjel + anion neve C O H5C 2OOC COOC2H5 O etil-butanoát dietil-hexándioát H5C2OOC etil-metil-malonát O C COOCH3 OC2H5 etil-ciklohexánkarboxilát Gyűrűs észterek: laktonok Amidok a.) sav nevében a „sav” vagy „karbonsav” utótagot „amid” utótagra cseréljük b.) triviális nevű karbonsav esetén: acilcsoport szótöve + amid 57 c.) sav neve + kötőjel + amid (funkciós csoport módosítását jelző név) Előtag: „karbamoil” (CONH2 csoport) a H2NCOOH szerkezetű karbamidsavból O O CH3 C NH2 NH2 a.) etánamid b.) acetamid c.) ecetsav-amid O NH2 pentánamid ciklohexánkarboxamid pentánsav-amid ciklohexánkarbonsav-amid COOH CONH2 2-karbamoilbenzoesav N-szubsztituált amidok: RCONHR’, RCONR’R”: mint nitrogénen
R’, R” csoporttal helyettesített származékok O O NH CH3 b.) N-metilbenzamid O NH N-fenilbenzamid benzanilid CH3 C NH N-fenilacetamid acetanilid Gyűrűs amidok: laktámok Nitrilek Más néven cianidok (pszeudohalogenidek) Általános képlet: R C N a.) Szubsztitúciós név: (savszármazékként) szénhidrogén neve + nitril, dinitril, karbonitril b.) Triviális nevű karbonsavakból levetetett nitrilek: acilcsoport szótöve + „onitril” c.) Csoportfunkciós név: R előtag neve + kötőjel + cianid 58 C N CH3C N a.) etánnitril b.) acetonitril c.) metil-cianid pentánnitril valeronitril butil-cianid NC butándinitril szukcinonitril CN CN CN ciklohexánkarbonitril ciklohexil-cianid benzolnitril benzonitril fenil-cianid Előtag: ciano CN COOH CN 4-cianopentánsav NC NC CN 3-(cianometil)hexándinitril Kémiai tulajdonságok Szubsztitúció karbonil szénatomon Reaktivitás, illetve egymásba való átalakíthatóság: CONH2 CN
2,4-dicianobenzamid 59 60 Reakciótípusok Észterek savas hidrolízise Észterek lúgos hidrolízise Gliceridek hidrolizíse: ld. előbb szappanok is 61 -Dikarbonilvegyületek Szerves vegyületek savassága: Stabil szerkezet kialakulása miatt, az egyensúly eltolódik az enol felé Enolát forma stabilizációja: 62 Claisen kondenzáció Dieckmann kondenzáció Acetecetészter szintézisek 63 Malonészter szintézisek Dekarboxilezés mechanizmusa: Szénsavszármazékok Néhány átalakítás: Részletesebben lásd a Novák-Nyitrai könyvet. Láncban szubsztituált karbonsavak (halogén, hidroxi) szintén. 64 AMINOSAVAK Aminosavak csoportosítása és nevezéktana Az aminosavak olyan karbonsavszármazékok, amelyekben a szénhidrogéncsoportok egy vagy több hidrogénjét aminocsoport helyettesíti. Az aminosavakat a szénhidrogénrész jellege (alifás/aromás), valamint az aminocsoportnak a karboxilcsoporthoz viszonyított helyzete szerint
osztályozzuk, és így megkülönböztethetünk -, -, - stb. aminosavakat, illetve aromás aminosavakat. NH2 R OH O -aminosav R NH2 NH2 OH O -aminosav R OH HOOC NH2 O -aminosav p-aminobenzoesav A különféle típusú aminosavak közül legjelentősebbek az -aminosavak, mert ezekből épülnek fel az élő sejt anyagállományának nélkülözhetetlen alkotórészei a fehérjék. Sokféle fehérjét ismerünk, így a fehérje elnevezés gyűjtőfogalom, hasonlóan a szénhidrogénekhez. A közismert tojásfehérje is sok száz különböző fehérje vizes oldata, melyből körülményes munkával tiszta, egységes fehérjéket lehet elkülöníteni. Ezek teljes hidrolízisénél aminosavak, részleges hidrolízisénél pedig peptidek keletkeznek A fehérjék és peptidek teljes hidrolízisével mintegy 20-féle aminosav nyerhető: monoamino-monokarbonsavak, monoamino-dikarbonsavak, továbbá második bázisos
(aminovagy guanidino-) vagy egyéb (hidroxil-, szulfanil-) csoportot is tartalmazó aminokarbonsavak, valamint izo- vagy heterociklusos szerkezetű részeket is magukban foglaló aminokarbonsavak. Különleges szerkezetű hidrolízis termékek a prolin és a hidroxiprolin, melyek -helyzetben gyűrűbe zárt, bázisos jellegű iminocsoportot tartalmaznak 65 Alapvető fontosságú (esszenciális) aminosavaknak nevezzük azt a 9 aminosavat, amelyeket a szervezet nem, vagy csak elégtelen mennyiségben képes előállítani: metionin, treonin, lizin, izoleucin, valin, leucin, fenilalanin, triptofán. hisztidin Aminosavak nevének eredete Néva Származásb Megjegyzés Arginin L, argentum, ezüst Jól definiált ezüstsót képez. Aszparagin L, asparagus, Először spárgában mutatták ki. spárga Aszparaginsav Az aszparaginnal rokon. Cisztein A cisztin redukciós terméke. Cisztin Glutaminsav G, kisztisz, hólyag Először húgykőből állították elő. glutén +
amino A sikér (glutén) hidrolízisével állítható elő; a sikér a gabonák nagy fehérjetartalmú komponense. Glutamin A glutaminsavból származik. Glicin G, glikisz, édes Hisztidin G, hisztion, szövet Izoleucin Édes ízű. A leucin izomere. Leucin G, leukosz, fehér Fehér lapok formájában képződik. Lizin G, lizisz, kibontás A kazein hidrolízistermékei között fedezték fel. Metionin metil + tio Kénatomot (a kén görög neve theion) és hozzá kapcsolódó metilcsoportot tartalmaz. Prolin pirrolidin Pirrolidingyűrűt tartalmaz. Szerin L, sericum, selyem Először selyemből állították elő. Treonin treóz Térbeli konfigurációja hasonlít a D-treózéhoz (ez utóbbi négy szénatomos cukor) Triptofán tripszines + fán Fehérjék hasnyámirigybeli emésztésével képződhet; a tripszin a hasnyálmirigynedv fehérjebontó enzime, a fán a görög phanein, megjelenni igéből származik. 66 Tirazin G, tirosz, sajt A sajtban
található. Valin valerián Szénváza megfelel az izovaleriánsavénak. a Ezeket a biológiailag fontos -aminosavakat szinte sosem említik a szisztematikus nevükön. Az -in végződés b gyakori a nitrogéntartalmú vegyületeknél (amin-bázisoknál). L: latin, G: görög Az aminosavakat a szubsztitúciós nómenklatúra szabályai szerint nevezzük el, de a természetben előforduló aminosavaknak triviális nevük van. Ez utóbbi nevek szimbólumai az angol névváltozat első három betűjéből adódnak – például glycine (Gly), alanine (Ala) stb. H2N OH H2N O 2- vagy aminoecetsav glicin (Gly) OH O 2- vagy -aminopropionsav alanin (Ala) Tyr-Gly-Gly-Phe-Leu (= Leu-enkefalin) Tyr-Gly-Gly-Phe-Met (= Met-enkefalin) Az aminosavakból levezethető acilcsoport nevét a triviális név in végződésének il-re való cseréjével kapjuk. H2N H2N glicil- O O alanil- Az -aminosavak fizikai tulajdonságai Sav–bázis jelleg Az
-aminosavak kristályos, magas olvadáspontú vegyületek. Olvadáspontjuk sokkal magasabb, mint azoké a karbonsavaké vagy aminoké, melyekből helyettesítéssel levezethetők. Olvadáspontjuk fölött elbomlanak, gázhalmazállapotban nem létképesek Oldékonyságuk is a sókra emlékeztet. Szerves oldószerekben, például alkoholban a prolin és a hidroxiprolin kivételével gyakorlatilag oldhatatlanok, míg vízben valamennyi jól oldódik. Oldatban, az oldat pH-jától függően kationként, anionként vagy ún. ikerionos alakban vannak jelen. Minthogy e vegyületek egyidejűleg bázikusak és savasak, a savas csoport (–COOH) átadja a protonját a bázisosnak (–NH2) és így keletkezik az ikerionos forma. 67 Az aminosavak ikerionos szerkezetű molekuláinak ugyanannyi a pozitív töltése, mint a negatív. A molekulák „bruttó” töltése tehát nulla, azaz vizes oldatban izoelektromos állapotban vannak. Nyilvánvaló, hogy vizes oldatban az alábbi
sav–bázis egyensúlyi rendszer jelenlétével kell számolnunk: O H2N O OH O R H3O H3N H2O O R anion gyenge sav gyenge bázis ikerion H2O O H3N OH R kation Az -aminosavak térszerkezete Az -aminosavak molekulái – a glicin kivételével – királisak és ennek megfelelően két tükörképi konfigurációba rendezhetők, melyeket a Fischer-féle jelölést használva L-, illetve Dbetűkkel különböztethetünk meg. A természetben előforduló aminosavak túlnyomó többsége az L-sorba tartozik és (S)-abszolút konfigurációjú, mint azt az R-(+)-glicerinaldehiddel történő kémiai korrelációjuk, valamint röntgenvizsgálataik is igazolták. Az L-cisztein esetén a CIP szabály alapján a prioritási sorrend miatt nem az (S)-, hanem az (R)-konfiguráció adódik. 4 1 2 3 (R)-cisztein Érdekes, hogy mikroorganizmusok [Gram (+) és (–) egyaránt] a „nem fehérjealkotó” Dkonfigurációjú aminosavakat is képesek felépíteni. A közismert
antibiotikum, a penicillin egyik jellemző építőköve a ,-dimetil-D-cisztein (penicillamin). 68 penicillamin penicillin alapváz Leegyszerűsítve két különböző típusú sejtfal található a baktériumokban, ezek alapján Grampozitív és Gram-negatív baktériumokra lehet felosztani a fajokat. A név a baktériumfajok osztályozására régóta használatos Gram-festés eredményére utal. A Gram-pozitív baktériumok sejtfala vastag, sok peptidoglikán (olyan molekulák, amelyekben a peptidekhez poliszacharidláncok kapcsolódnak kovalens kötéssel), és lipoteichonsav réteget tartalmaz. A Gram-negatív baktériumok ezzel szemben viszonylag vékony sejtfallal rendelkeznek, mely csak néhány réteg peptidoglikánból áll, melyet lipopoliszacharidokat és lipoproteineket tartalmazó második lipidmembrán burkol. A legtöbb baktérium a Gram-negatív csoportba tartozik, csak a Firmicutes és Actinobacteria nemzetség tagjainak van Gram-pozitív sejtfala. A
felépítésbeli különbségek eltérő érzékenységet eredményeznek az antibiotikumokkal szemben, például a vancomycin csak Gram-pozitív baktériumokat tud elpusztítani, és Gram-negatív patogénekkel, mint például a Haemophilus influenzae vagy a Pseudomonas aeruginosa fajokkal szemben hatástalan. teichonsav vancomycin A Gram-festés egy sejtfestési eljárás; empirikus (gyakorlati) módszer baktériumok csoportosítására. A módszer Hans Christian Gram (1853-1938) dán kutató munkájának eredménye, aki 1884-ben felfedezte, hogy a baktériumokat két csoportra lehet osztani aszerint, hogy lilára festhetők-e vagy sem: Gram-pozitív baktériumok azok, amelyek kékre/lilára színeződnek és Gram-negatív baktériumok azok, amelyek rózsaszín/piros színt kapnak. 69 Aminosavak kimutatása: színreakció ninhidrinnel, csak rájuk jellemző (a prolin kivételével). Peptidek -Aminosavakból felépülő 2-100 egységből álló polimerek
Csoportosításuk oligopeptidek 2-10 aminosav polipeptidek 10-100 aminosav proteinek 100 > aminosav A peptidek szerkezete H2N COOH H2N Q COOH R H 3O (6M HCl) - H 2O O H2N R N Q COOH H savamid (peptid) kötés A peptideket nyílt láncú és nagy tagszámú gyűrűs peptidekre osztjuk. A nyílt láncú peptidekben a lánc egyik végén az aminocsoport szabad, ez az N-terminális rész (Nterminus), a másik végén a karboxilcsoport szabad, ez a C-terminális rész (C-terminus). Lúgos közegben anionként, savasban kationként vannak jelen, izoelektromos pontjukon pedig dipoláris ionkét. 70 Röntgendiffrakciós vizsgálatokkal megállapították, hogy a peptid molekulákban a kapcsolódó atomok egy síkban vannak, a savamid kötés transz-térállású, és a kötéstávolsági adatok szerint a C-N kötés a konjugációs kölcsönhatás következtében kettőskötés jellegű. A savamidokra jellemző konjugációs kölcsönhatás következtében a szabad
rotálás nem következhet be a savamid kötés mentén, így a stabilis transz-téralkat energetikailag kedvező állapotot biztosít a molekulának. Ugyanakkor a savamid kötés a legstabilabb kötés, csak erélyes körülmények között bontható fel (tömény sósav, forralás). Néhány jelentős természetes peptid Glutation: tripeptid, glu-cys-gly; oxidációs-redukciós folyamatok partnere, a szulfidcsoport diszulfiddá oxidálódik HOOC NH NH NH2 A SH O O COOH 2 G-SH AH2 G-S-S-G B BH2 Oxitocin és vazopresszin agyalapi mirigy hormonjai. oktapeptidek, majdnem azonos szerkezetűek, két aminosav különbözik bennük oxitocin: méhösszehúzó hatású, a tejelválasztást segíti elő vazopresszin: vérnyomás szabályozása és a vizelet kiválasztása (antidiuretikus hormon) 71 vazopresszin oxitocin Cikloproteid antibiotikumok: gramicidin-S (D-konfigurációjú aminosavat is tartalmaznak). -Amanitin: Gyilkos galóca (Amanita phalloides) A
gyilkos galóca háromféle toxincsoportot tartalmaz: amanitineket, falloidineket és virotoxinokat. Ezek olyan ciklikus oligopeptidek, amelyeket a szervezet enzimei nem tudnak lebontani, tehát hatástalanítani. A legveszélyesebbek közülük az amanitinek A lappangási idő hosszú, vagyis a tünetek csak jóval a gomba elfogyasztása után (8-24 óra múlva) jelentkeznek, amikor a méreg már felszívódott a tápcsatornából, ezért a gyomormosás nem sokat használ. A toxin a májkapuvénán keresztül a májba jut és egyenesen a májsejtekhez kötôdve, azok pusztulását okozza. Jelentősen károsodik a vese is Az amanitin hatása a sejtek DNS-től függő RNS polimerázának gátlásán alapul: a sejtben megszünik a fehérjeszintézis. Az -amanitin csak a melegvérű állatok DNS-polimerázára hat, ezért pl. a csigarágott 72 termőtest még lehet mérgezô! A gyilkos galócában található egyéb toxinok, a falloidinek és virotoxinok kevésbé mérgezôk és
rosszabbul is szívódnak fel. Mellitin (méhek fullánkmérge): Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro~~Ala-Leu-Ile-Ser-Trp-Ile-LysArg-Lys-Arg-Gln-GlnNH2 (vagy GIGAVLKVLTTGLPALISWIKRKRQQNH2) Inzulin (diabetes mellitis kezelése) Fehérjék nagy molekulasúlyú, többszáz aminosavból felépülő makromolekulák az élő szervezet legfontosabb anyagai 20-féle aminosavból épülnek fel, kapcsolódási lehetőségük korlátlan Csoportosítás 1) Összetétel alapján Protein (egyszerű), hidrolízissel -aminosavak képződnek Proteid (összetett protein), hidrolízissel -aminosavak és egyéb anyagok képződnek foszfoproteidek: kazein kromoproteidek: hemoglobin (színesek) mukoproteidek: szénhidrátot tartalmaznak lipoproteidek: zsírszerű anyagot tartalmaznak nukleoproteidek: nukleinsavat tartalmaznak, DNS metalloproteidek: fémek komplexei 2) Oldékonyság alapján Albuminok: vízben oldódnak (vérsavó, tojásfehérje)
Globulinok: neutrális sóoldatban oldódnak (fibrin) Prolaminok: vizes alkoholban oldódnak Hisztonok: ammoniával kicsaphatók Szkleroproteinek: oldhatatlanok, stabilisak (vázfehérjék) 3) Koaguálás alapján (fémion, sav, fizikai hatásra, hő, rázás hatására bekövetkező változás) Reverzibilis fehérjék (külső hatásra koagulálnak, a hatás megszűnése után visszaalakulnak): felvert tojásfehérje Irreverzibilis (denaturálás): rántotta 73 4) A fehérjemolekula alkata alapján Fibrilláris fehérjék: fonál alakúak (haj, izomrost) Globuláris fehérjék: gömb alakúak (sejt legtöbb fehérjéje) 5) Biológiai hatás alapján Inaktív fehérjék (vázanyagok): haj, köröm, bőr, kollagén (inak, kötőszövetek), miozin (izom) Fiziológiailag aktív fehérjék (bioregulátorok): anyagtranszportot szabályozzák hormonok (inzulin) enzimek (pepszin) vírusok (dohánymozaik-vírus) bakteriofágok toxinok (kígyómérgek)
antitestek Proteinek sajátságai Nagy molekulasúly, kolloid sajátságú anyagok Legtöbb liofil kolloid, vagyis oldószerrel szolvatálódnak, ezért duzzadnak meg oldódáskor Színreakciók kimutatásra Xantoprotein-próba: tömény salétromsav hatására a tirozin vagy triptofán aromás gyűrűjének nitrálódásával jellemző sárga szín keletkezik Biuret-próba: lúgos réz-szulfát oldattal élénk ibolyaszínű réz-komplex képződik (Magyarázat: melegítés hatására a fehérjék aminocsoportjából ammónia és biuret keletkezik, amely lúgos közegben réz(II)-szulfáttal vörösesibolya színű komplexet képez). Biuret allofánsav Ninhidrin-próba: kékes ibolyaszín ninhidrinnel (ld. aminosavaknál) O OH OH Amfoter jellegűek O 2,2-dihidroxiindán-1,3-dion A fehérjék primer szerkezete = a kapcsolódó -aminosavak sorrendje A fehérjék szekunder szerkezete Az alapkonformációt -kötések, ugyanakkor a legstabilabb állapot
kialakulását a nem kovalens kötések határozzák meg (hidrogénhidak, van der Waals erők). Röntgendiffrakciós vizsgálatok megállapították, hogy a polipeptidlánc térbeli elhelyezkedése a legstabilabb kétféle pozícióval: redőzött vagy -struktúra, ill. hélix struktúra 74 Redőzött struktúra A fehérjemolekulák között kialakul a hidrogénkötés, azonban a nagy térkitöltésű oldalláncok van der Waals taszítása következtében ezek nem lehetnek stabilisak. H O N R H H O R H N N N N O H R H O H R H O H H R O H H R O H N N N O H R H N N O H H R H O A peptidkötésnek olyan kedvező konformációt kell felvennie, hogy zavartalanul alakulhassanak ki a hidrogénkötések, és a van der Waals rádiuszok is megfelelőek legyenek. Az amidkötésben a nitrogénatom nemkötő elektronjai konjugációs kölcsönhatásba kerülnek a karbonilcsoporttal, ez azt eredményezi, hogy az amidkötés mentén a szabad rotálás
gátolt és így rögzített lesz. A szabad rotálás viszont az N-C(R)H ill. a H(R)C-C tengely körül lehetséges, úgy hogy az amidkötés síkja elfordul H R H O N N H O H R H O N N H O Az elfordulás következtében a közvetlenül kapcsolódó szomszédos atomok konformációja nem változik meg, ellenben megváltozik az egymáshoz kapcsolódó szomszédos atomok viszonylagos helyzete. 75 Ebben az esetben lesz a közvetlenül kapcsolódó atomok van der Waals rádiusza a legmegfelelőbb. A redőzött (plisszírozott) struktúra, mint energetikailag stabilis konformáció kialakulása, lehetővé teszi a peptidláncok közötti hidrogénkötések létrejöttét úgy, hogy az Rcsoportok is maximális távolságra kerüljenek egymástól. A selyemhernyó szál: fibroin, redőzött strukturájú, erős, de nem nyújtható, viszont hajlékony. Erős: stabilis H-kötések, ezért nem szakad el, és nem nyúlik meg Hajlítható: a gyengébb van der Waals
kölcsönhatások következtében, elcsúszhatnak a rétegek 76 Pókháló szerkezete: A szál belsejében kristályos területek is vannak, amiket amorf kapcsolódások választanak el. Hélix struktúra A fehérjelánc egy képzeletbeli henger palástján tekeredik fel csavarvonalszerűen = hélix. Az -hélixekben az N-H és C=O csoportok párhuzamosak a hélix tengelyével, míg az R-szubsztituensek a hengerpalástból kifelé állnak (extrovertált szerkezet). Minden egyes csoport olyan távolságra van egymástól, hogy intramolekuláris H-kötés alakulhat ki minden amidcsoport karbonilcsoportja és az előtte levő harmadik amidcsoport N-H-ja között. Az hélixben egy menetet 3-6 aminosavrész alkot, és 5 menet után kerülnek tökéletesen azonos helyzetbe. Az -hélix átmérője 10,5 Å, amely a legmegfelelőbb távolság a maximális van der Waals kölcsönhatásra. 77 -Hélix szerkezetű a fibrilláris fehérjék sorában tartozó keratin, amely a
haj, szőr, gyapjú, toll fehérjéje. Haj: 3-3 hélix tekeredik össze, háromszálú hélixet alkotva; ezek tovább rendeződnek, két háromszálú hélixet kilenc másik vesz körül, így stabilis, vastag kötegek jönnek létre, melyeket diszulfidhidak is összekapcsolnak, merevítenek. Tartós hullám (dauer) készítése: 78 Kollagén: a kötőszövetek, az inak, porcok fehérjéje. Aminosav tartalmának kb 1/3-a prolin és hidroxiprolin. Ezekből nem alakulhat ki sem -hélix, sem redőzött struktúra A láncok csaknem nyújtottak, meredeken csavarodó (egy menet kb. 30 aminosav) hélixet (-hélix) alkotnak úgy, hogy három lánc tekeredik össze és a molekulák közötti H-kötés tartja össze a láncokat. A kollagén rostok nem nyújthatók, meglehetősen szilárdak, így a szervezet számára kitűnő tartó, merevítő szerkezeti elemek. Szénhidrátok (cukrok) A cukor rövid története A legrégibb édesítő anyag a méz volt. A nádcukor hazája India Az
első hírt a cukorról Nagy Sándor két hadvezére hozta Európába Kr.e 327, indiai hadjáratukról hazatérőben. Akkor még a cukornád levét használták édesítőként A szilárd cukor felfedezése kb. Kre 300-600 körül tehető, ezt az indiaiak szákkárának nevezték, ami homokot jelent. Kínában is innen terjedt el Cukorgyártás kezdete: Perzsia, Kr.u V sz a perzsák a vörös színű nyerscukrot hívták szákkárának, a fehér kristályos cukrot kánd névvel hozták forgalomba. (innen a kandis cukor elnevezés, egykristály-cukor, jégcukor) Európában az arabok hozták be, kik meghódítván Perzsiát, a cukorgyártás mesterségét is eltanulták, szukhárnak nevezték, innen ered a neve. Az arabok hódításait nyomon követte a cukor elterjedése is. Cukor névadás: sakkara óind sukkar arab szakhar(on) görög saccharum latin sucre francia zucchero olasz Zucker német sukker norvég cukier lengyel cukor magyar, szlovák zahâr román 79 sugar angol caxap
orosz Magyarországon: kb. a XIV sz lett ismeretes; 1419-ben Zsigmond, 1476-ban Mátyás király ünnepi lakomáján szerepelt, mint drága asztaldísz. Először nagyrészt az olaszok készítették a cukros süteményeket, akik gyógyszerekkel is üzérkedtek. 1750 első finomító, Mária Terézia, Fiume, holland RT. 1747: Margraff András Zsigmond (1709-1789) német kémikus bebizonyította, hogy ua. az anyag van hazai növényekben is, pl a répában Achard Ferenc (1753-1821), fenti tanítványa, fektette le a gyártás alaptételeit répából. XVIII. sz Debrecenben épül kísérleti répacukorgyár, Gertinger János Sámuel eperjesi gyógyszerész támogatása által. Édesítőszerek: Szénhidrátok szerepe A szénhidrátok (cukrok) felépítésük szerint, a régi megközelítéssel a szén hidrátjainak tekinthetők. 1. energiahordozók 2. növényekben: fotoszintézis (CO2)n + (H2O)n h (CH2O)n + (O2)n klorofil üzemanyagpótló EtOH Szervezetben: cukorlebontás
iparban keményítõ glükóz H2O + CO2 675 kcal / mol 3. vázanyagok: a szénhidrátokból keletkező polimerek (cellulóz, kitin) 4. biológiai információk hordozói: A szénhidrátok és konjugátumaik (glikopeptidek, glikolipidek) az élő sejt felületén gondoskodnak a sejt adhézióról (tapadás), részt vesznek a sejt osztódás gátlásában, szerepük van a vírusok, baktériumok és hormonok valamint toxinok sejten való megkötődésében és irányítják az immunválaszt. Szerepük van az ivarsejtek egymásra találásában Mint nukleozidok alkotóelemei közvetői a genetikai folyamatoknak (RNS, DNS, receptorok a sejt membrán felületén / glikolipidek, glikoproteidok) 5. királis kiindulási anyagok A szénhidrátok felosztása egyszerű szénhidrátok: hidrolízissel nem bonthatók tovább 80 diszacharidok: hidrolízissel egyszerű szénhidrátokká bonthatók oligoszaharidok (összetett cukrok): tíznél kevesebb egyszerű szénhidrátot
tartalmaznak poliszaharidok (cukrokhoz nem hasonló, összetett szénhidrátok): tíznél több egyszerű szénhidrátból felépülő makromolekulák Egyszerű szénhidrátok Közös jellemvonásuk: Csoportosítás 1. hidrolízissel nem bonthatók fel általában édes ízűek vízben oldódnak Oxocsoport jellege szerint: aldózok ketózok O CH2 (CH)n C OH 2. OH OH OH aldóz O OH ketóz A kapcsolódó szénatomok száma szerint: aldóz trióz tetróz pentóz hexóz 3. CH2 (CH)n C CH2 H ketóz 0 1 2 3 n 1 2 3 4 Az oxocsoporttól legtávolabb levő szénatom konfigurációja szerint: D-, vagy Lkonfiguráció (a ketotrióz kivételével minden molekula egy, vagy több aszimmetriás centrumot tartalmaz) CHO H C OH CHO HO C H CH2OH C O H C OH CH2OH C O HO C H CH2OH CH2OH CH2OH CH2OH D- L- D- L- 81 Szénhidrátok térszerkezetének ábrázolása: Fischer-féle projekció ox C H red 2 CHO 4 H C OH 1 CH2OH 3 CHO CHO 2x OH HO H CH2OH CH2OH D
L CHO HO C CH2OH H HO CHO CH2OH R 82 CHO H OH HO H H OH H OH CH2OH CHO CHO CHO CH2OH CH2OH CH2OH D-galaktóz D-mannóz epimer cukrok egy OH konfigurációjában különböznek D-glükóz 8 db D 24=16 8 db L A szénhidrátok egyensúlyi elegyében a nyílt láncú forma és a ciklofélacetál öt- vagy hattagú gyűrűs állapotban található Haworth-Böeseken-képlet (piranóz, illetve furanóz, a megfelelő heterociklusok analógiájára): IR spektroszkópiával ugyanis nem mutatható ki a karbonilcsoport, tehát spontán, reverzibilis intramolekuláris nukleofil addícióval ciklofélacetálokként vannak jelen. O O pirán piranóz CHO CHO O O furán furanóz H O CH2OH C 2x csere O OH HOH2O O H HOH2C CH2OH H OH CH2OH O CH2OH H O H H OH + H OH -anomer -anomer 83 OH CHO CH OH OH HO O OH CH2OH HO H OH O OH + OH OH O H OH CH2OH -D-furanóz -D-furanóz A jobb oldali OH (Fischer képlet) alulra
kerül (Haworth képlet), a bal oldali OH (Fischer) felülre kerül (Haworth). Az anomerek keletkezésére (és tulajdonképpen a gyűrűs szerkezet kialakulására) a mutarotáció jelensége hívta fel a figyelmet. A kristályosítás módjától függően kétféle forgatóképességű D-glükóz (vagy egyéb cukor) ismeretes. jégecet [] = + 112,2° -D-glükóz szilárd oldat [] = +52,2o alkohol [] = + 18,7o -D-glükóz szilárd A kétféle D-glükózból, állás közben azonos [D] = +52,7o-os forgatóképességű oldat keletkezik. Ezt a forgatóképesség megváltozást nevezik mutarotációnak (mutáció = változás, rotáció = forgatás). A forgatóképesség megváltozása és azonos értékű végállapota egyensúly kialakulására utal. Mivel a mért érték nem középérték, azt jelenti, hogy az egyik anomerből több keletkezik, és ez a -anomer (63%), amelyik a stabilabb konformer, ebben ugyanis a hidroxil csoportok mind transz térállásúak
(-anomer 36%, nyílt forma 1%). Hexózok konformációja 84 a e e a O C1 konformer (stabilabb) 5 OH O 3 4 OH 4C 1 OH 6 5 1 4 O OH OH 2 OH O 1C konformer OH OH O OH 3 1 2 OH 4 5 HO HO 2 3 OH O OH 1 OH 4 C1 legstabilabb szerkezet H mind axiális OH, CH2OH mind ekv. csupa transz a felső és az alsó index a C-1 és C-4 szénatomok relatív helyzetére utal) -D-glükopiranóz Az oxocsoport reakciói Az aldozók kimutathatók ezüsttükör (ammoniás ezüst-oxid – Tollens)- vagy Fehlingpróbával (réz-szulfát + Na,K-tartarát + NaOH oldat), mivel kis mennyiségben nyitott formában is jelen vannak vizes oldatban. Tollens teszt Fehling teszt 85 Fontosabb monoszacharidok és rokon vegyületek D-Glükóz CH2OH CHO H OH HO H H OH H OH OH Ni / H2 HO H Bacterium xylinum red. H OH ox. (C-5 OH) H OH H OH O HO H HO H H OH H OH O HO H CH2OH CH2OH CH2OH CH2OH H CH2OH CH2OH D-szorbit L-szorbóz D-ribóz
és 2-dezoxiribóz (pentóz) A nukleinsavak építőkövei közé tartoznak. CHO CHO OH HO O OH OH OH CH2OH H OH H HO O OH OH OH OH OH CH2OH L-aszkorbinsav (C-vitamin) 2-dezoxi-2-keto-L-gulonsav -laktonjának enol alakja (gyűrűs észter forma) Szent-Györgyi Albert (1933 Nobel-díj) Lebontás (könnyen oxidálódik – levegőn is – a kettős kötés miatt): OH H OH O O - 2H H O OH L-aszkorbinsav C-vitamin források /100 g : Rosa canina COOH OH O + 2H OH COOH OH O HO OH dehidro-L-aszkorbinsav Capsicum annuum COOH OH O csipkebogyó: 400 mg zöldpaprika: 125-180 mg káposzta: 87 mg citrom: 45 mg burgonya: 24 mg tej: 1-2 (4-7) mg oxálsav ox. L-treonsav napi igény: 75 mg Brassica oleracea Citrus limon 86 Solanum tuberosum tej Diszacharidok a) Nem redukáló diszacharidok Két cukor glikozidos hidroxilcsoportjának kondenzációja (glikozid képzése) révén vezethetők le. Szacharóz (répacukor 20%, nádcukor 15%) „a cukor”
fruktofuranozid cukornád -D-glükopiranozil--D- cukorrépa A szacharóz híg ásványi savakkal vagy enzimatikus úton D-glükózra és D-fruktózra hidrolizál. A hidrolízis során a cukoroldat forgatóképessége folyamatosan csökken, eléri a nulla értéket, majd balra forgatóvá válik, mivel a fruktóz erősebben forgat balra, mint a glükóz jobbra. A forgatóképesség előjelének megváltozása miatt a szacharóz hidrolízisét invertálásnak, és az így nyert egyszerű cukor keveréket invertcukornak („műméz”) nevezik. A mézhamisítás leggyakoribb módja a virágmézként árult műméz. A műméz invertcukorból aromás anyagok (néha zamatos méz) hozzákeverésével és festékanyagok színezésével készül. 87 A hamisítást könnyen felismerhetjük, ha egy kávéskanálnyi mézet tiszta szeszben feloldunk. Amennyiben teljesen oldódik, úgy a méz tiszta. Ellenkező esetben homályos lesz és rövid idő múlva a belekevert anyag
leülepedik. b.) Redukáló diszacharidok A vízkilépés az monóz glikozidos hidroxilcsoportjából történik (4 vagy 6). OH HO O H OH OH OH -D-glükóz -D-glükóz OH OH valamelyik alkoholos - H2O O OH O H OH OH OH OH OH OH 6-(-D-glükopiranozil)-D-glükóz = genciobióz OH OH O H OH OH OH -D-glükóz -D-glükóz O OH H OH HO OH monóz O OH H OH OH másik OH OH O a 6 O OH OH és - H2O O H OH OH OH O OH OH OH 4-(-D-glükopiranozil)-D-glükóz = maltóz OH OH OH O O OH OH OH H OH O OH H HO OH OH -D-glükóz -D-glükóz O OH - H2O OH O OH H OH OH OH OH 4-(-D-glükopiranozil)-D-glükóz = cellobióz OH OH OH OH O OH OH OH H OH -D-galaktóz (C-4 epimer) O OH O OH H HO OH -D-glükóz OH - H2O O OH OH OH O H OH OH 4-(-D-galaktopiranozil)-D-glükóz = laktóz = tejcukor Genciobióz: a crocin összetevője, ami a sáfrány (Crocus sativus) sárga színéért
felelős (fűszernövény). Maltóz: malátacukor, a keményítő részleges hidrolízésével nyerhető. Cellobióz: a cellulóz részleges hidrolízésével nyerhető. 88 Laktóz: tejcukor, az emlősök tejének cukorkomponense (az anyatej 5-8% laktózt tartalmaz) Aminocukrok A természetben előfordulnak 2-amino-2-dezoxi, 3-amino-3-dezoxi, stb. monoaminohexózok Számos bakteriális poliszacharidban poliamino-polidezoxi cukor található A leggyakoribb aminocukor a glükózamin, a 2-amino-2-dezoxi-D-glükóz: OH O OH OH HO NH2*HX Diszacharidok közül említjük a kitobióz néven ismert 14-kötésű molekulát, mely 2glükózaminból épül fel: OH O OH OH O OH OH O NHR HO NHR kitobióz (R = H, ilyenkor HCl-só formájában van) kitin (R = CH3CO-) Kitin rákok, rovarok vázanyaga Kénsavval észteresített származékai: emberi, állati porcogó, inak, kötőszövetek „gélszerű” állományának alkotórészei Heparin véralvadásgátló, hasonló szerkezetű
poliszacharid (korlátozza a trombokináz enzim műkődését, amelynek a véralvadás előidézésében döntő szerepe van) kimutatás: májban, Mc Lean, 1916 89 OH O COOH O O O NaOSO2O OH OH OH NHSO2ONa O COOH O O O NaOSO2O NHSO2ONa OH O OSO2ONa Heterociklusos vegyületek Gyűrűs vegyületek, amelyek a szénatomok mellett heteroatomot(okat) is tartalmaznak, pl: O, N, S, valamint B, Si, P, As, Sb, Sn, Pb, utóbbiak mesterségesek. Felosztás 1. 2. gyűrűrendszer alapján a.) a gyűrűk tagszáma, heteroatom minősége és száma, helyzete szerint b.) a gyűrűk telítettsége szerint: telített, részlegesen telített, telítetlen gyűrűk elektronrendszere alapján: a.) aromás (heteroaromás) b.) nem aromás Nevezéktan a.) triviális név: barbitursav, piridin, atropin, flavon, stb b.) szisztematikus név: IUPAC (International Union of Pure and Applied Chemistry) Heteroatom jelölése: O oxa S tia N aza A Hantzsch-Widman rendszer végződései:
Gyűrűméret 3 4 5 6 7 8 9 10 prefixek, de ha magánhangzó következik, az a elmarad telítetlen -irén* -et -ol -in -epin -ocin -onin -ecin telített -irán* -etán -olán -án -epán -okán -onán -ekán * A tradicionális „-irin” végződés használható, ha a gyűrű csak nitrogént tartalmaz. * A tradicionális „-iridin”, „-etidin” és „-olidin” végződéseket preferáljuk a nitrogént is tartalmazó telített három-, négy- vagy öttagú gyűrűs heteromonociklusok esetén. 90 O O S S oxirén oxirán (etilén-oxid) tiirén O O S oxet oxetán O O oxol (furán) oxolán (T HF) O O N N H H tiirán azirin aziridin (etilén-szulfid) (etilén-imin) S N N tiet tietán azet azetidin S S N N H H azol pirrol azolidin pirrolidin tiol (tiofén) tiolán (THT) O S S H S N N H 2H-pirán (-pirán) 4H-pirán (-pirán) oxán 2H-tii n 4H-tii n tián piridin (THP) (-tiopirán) ( -tiopirán) (perhidrotiofén) A
számozás mindig a heteroatomon kezdődik! Több azonos heteroatomot tartalmazó gyűrűk elnevezése azinán (piperidin) 91 *az oxin név nem használható a pirán esetében, mivel ezt korábban a kinolin-4-ol triviális neveként használták * az azin név nem használható a piridin esetében, mivel ez régóta használatos az =N-N= típusú vegyületcsalád elnevezésére H2N NH2 R CH O - H2O R O N NH2 CH R - H2O hidrazon R N N R azin Eltérő heteroatomot tartalmazó gyűrűk elnevezése Kondenzált heterociklusok elnevezése 4 c 3 b 2 5 a O 1 O benzo-(2,3)-furán benzo[b]furán (kumaron) O O furán benzo-(3,4)-furán benzo[c]furán (izokumaron) Öttagú heterociklusos vegyületek ' ' O furán O benzofurán S tiofén N H pirrol O dibenzofurán S benzotiofén N H benzpirrol (indol) N H dibenzpirrol (karbazol) dibenzofurán 92 Kötésrendszer N H N H H N 0,2 - 0,2 - 0,2 - 0,2 N 0,8+ H A nemkötő
elektronpár részt vesz az aromás rendszer kialakításában A heteroatom Y sp2-hibridállapotú és parciális pozítiv töltés kerül rá, ha a nemkötő elektronpárja delokalizálódik a gyűrűben. Ennek a delokalizációnak a csökkent dipólus momentum a következménye, ha összehasonlítjuk a megfelelő telített származékokkal. A furán és a tiofén esetében a rezonancia hatása nem elég ahhoz, hogy túllépje az elektronegativitás mértékét, ezért a negatív pólus a heteroatomokra tevődik. A pirrol esetén a rezonancia hatása a dipólus momentumra olyan erős, hogy megfordul ennek iránya. aromás jelleg: tiofén > pirrol > furán k SE benzol < pirrol(,’) > tiofén < furán reaktivitás: pirrol > furán > tiofén > benzol Reaktivitás Bázikus jelleg Pirrol: nem bázikus, ez a nemkötő elektronpár delokalizációjára utal. N H pKb szek. amin, erős bázis 3,2 N H nem bázis 13,6 93 Furán: enol-éter (konjugált dién)
jellegű, sav hatására gyűrűfelnyílás, majd gyantásodás következik be (mivel az aromás rendszer szűnik meg, hosszas savas főzés, nagy savkoncentráció szükséges). H2O H H2O O O -H OHC OH HO H enol CHO gyanta szukcinaldehid Savas jelleg Pirrol: a konjugáció következtében a heteroatomon lecsökken az elektronsűrűség, így N-H savként működik. Ezért reagál káliummal vagy Grignard-reagenssel, és ebből kifolyólag számos származék állítható elő. K N N H + 1/2 H2 K Q-Hlg pKa ~ 15 RMgX Q-Hlg N N Q H Q Q = alkil, acil N MgX , majd víz CO2 N O N C OMgX COOH H Elektrofil szubsztitúciós reakciók A -komplex kialakulása könnyebben megy végbe, mint a benzol esetében, a -komplex pedig az szénatomon kedvező. H H E X E H X X E X H E X E H X E Hammond-elv! 94 Stabilabb átmeneti állapoton keresztül kedvezőbb a reakció, tehát a szubsztitúció helyzetben játszódik le. Reakciók
Brómozás, nitrálás, szulfonálás: Br2 / 0oC Br2 / 5oC X X Br X NO2 Br Br X HNO3 Ac2O X A nitrálás nem érintheti a heteroatomot, ezért használunk enyhébb reakciókörülményeket: HNO3 H O NO3 O O O OH O - AcOH H3C C O NO3 H3C C O O O N O O H3C C Hajtóerő: az acetát anion nagyfokú stabilitása Öttagú heterociklusok benzológ származékai X X Fontosabb vegyületek: O benzofurán NH benzopirrol (indol) O NO2 95 HO COOH NH2 N NH2 N H H triptofán (Trp) szerotonin (vérnyomás hormonja) HO COOH NMe2 N N H H bufotenin (varangyméreg- Bufo bufo) mérges gombákban is 3-indolilecetsav (heteroauxin - növényi növekedési hormon) Európai közönséges varangy Bufo bufo A szerotonin a vérnyomást szabályozza, felhalmozódása esetén alszunk, eközben elbomlik, ekkor ébredünk. Ha gátolt a képződése, a kóros álmatlanság lép fel Alkohol hatására képződik. Az indolilecetsav a növények hosszanti
növekedéséért felelős; a hasonló szerkezetű klórfenoxiecetsavak ellentétes hatásúak (auxinantagonisták): O COOH Cl herbicid (gyomirtó) Indigó Az Indigofera fajok tartalmazzák az indoxil-glükozidot, az indikánt, amely enzimatikusan hidrolizál indoxillá. Az indoxil levegőn, állás közben kék színű, a vízben oldhatatlan indigóvá oxidálódik. OH H O O OH OH OH OH O H - glükóz N N N H H H (glikozid = aglikon + cukorrész; glükozid = aglikon + glükóz) H N O2 enzim N O O 96 Öttagú, két heteroatomot tartalmazó heterociklusok N N N O S N H oxazol tiazol imidazol 1,3-diazol O N S N N H izotiazol izoxazol N pirazol 1,2-diazol N N N O S benzoxazol benztiazol N H benzimidazol Kötésrendszer N N N SE N H ' " N N H ' - 1/2 + 1/2 ' Az imidazol tökéletesebb aromás rendszer, mint a pirrol. Bázikus
tulajdonságú vegyületek, de a pirazol és az imidazol, savas protonjuk miatt, amfoter jellegűek 97 imidazol N N N N N N N N H H R R 4 2 H 5 N N N H H N3 1 1 N 4 HN NH 3N H 2 4(5)-R-imidazol gyors protonvándorlás (virtuális tautoméria) Az R csoport jelenlétében, már nem azonos a két tautomer. pirazol : csak dimer N N H H N N Természetes vegyületek Alapvázak: 4 pirrol gyűrű, metilénhidakkal összekötve 2 CH CH 3 1 CH 4 NH NH N HC HC 5 8 CH porfin HN N 8 6 N CH HN N 7 CH N N 7 CH N NH CH CH klorin korrin Hemoglobin A hemoglobin a gerincesek vörös vérsejtjeiben lévő összetett fehérje (kromoproteid). Oxigénszállító szerepét régen felismerték és már 1862-ben kristályosan el is tudták különíteni. A hemoglobin fehérjementes része egy szubsztituált porfinvázas vegyület a porfirin vas(II)komplexe. A hem totálszintézisét és ezzel szerkezetének felderítését H Fischer (1929)
valósította meg. A fehérjerész hisztidin nitrogénje a porfinváz síkjára merőleges irányból koordinatíve kapcsolódik a központi vas(II)-atomhoz. Ezzel ellentétes oldalról a vas(II)-atom egy oxigénmolekulát képes megkötni. Az oxigéntartalmú fehérjét oxihemoglobinnak nevezzük. 98 CH2 HC CH3 CH H3C N HC N H3C O CH CH2 N II Fe N N N N CH3 H2C H2C N Fe CH CH O kordinatíve kötött oxigén N fehérje CH2 CH2 COOH NH COOH a hemoglobin hemje a hem síkja a fehérje hisztidin része az oxihemoglobin szerkezete Szénmonoxid mérgezés: Karboxihemoglobin Epefestékek Az epefestékek szerkezetileg és genetikusan szorosan összefüggnek a purinvázas vegyületekkel. A hemoglobin hemjének természetes lebomlási termékei, melyek vasmentesek és már nem tartalmaznak porfinvázat. Az oxidatív lebomlás főként a májban megy végbe A hemoglobin hemjéből először biliverdin képződik, ami enzimes redukcióval bilirubinná alakul. A
bilirubin tovább bomlik egyéb pirrolvázas vegyületekké, majd kiürül a szervezetből hemoglobin hemje biológiai oxidáció COOH COOH H3C HO N CH2 CH2 CH2 CH2 CH H3C CH2 CH2 CH3 H3C CH CH N CH N CH N OH H biliverdin redukció COOH COOH H3C HO N CH2 CH2 CH2 CH2 CH H3C CH2 CH2 CH3 H3C CH CH N CH2 H N H bilirubin CH N OH 99 Klorofill A klorofill a Nap sugárzó energiáját abszorbeálja és közvetíti a növényi sejtek energiát igénylő szintetikus folyamatai számára. A klorofill viaszállományú, rendkívül érzékeny vegyület, ami már enyhe behatásra (levegő, fény, savak, lúgok stb.) is irreverzibilis változást mutat. A klorofillt Willstätter (1904-1913) különítette el először tisztán és megállapította, hogy két hasonló szerkezetű anyag keveréke. A két vegyület, a klorofill-a és a klorofill-b csak a 3-helyzetű szénatom szubsztituensében különböznek. A 7,8-dihidro-porfinváz komplex kötésű
magnéziumot tartalmaz. A gyűrű oldalláncában lévő egyik karboxilcsoportot egy diterpénalkohol, a fitil-alkohol észteresíti. H2C HC R CH H3C 3 N CH Mg HC N N H3C H H2C CH2 CH3 N CH3 C H H2C H O C O O COOCH3 CH3 H3C fitil-csoport H H3C CH2 H CH3 CH3 klorofill-a (R=CH3) klorofill-b (R=COH) B12-vitamin A B12-vitamin hiánya vészes vérszegénységet okoz. A betegség kezelésére korábban máj kivonatot használtak, de a tiszta hatóanyagot a sztreptomicin gyártás során visszamaradó anyalúgból izolálták (Folkers, 1948). A B12-vitamin sötétvörös kristályos vegyület, optikailag aktív – vizes oldata balra forgató. Szerkezetét röntgendiffrakciós módszerekkel 1957-ben tisztázták, amit 1971-ben totálszintézissel igazoltak (Woodward, 1971). A B12-vitamint szerkezete alapján cianokobalaminnek nevezték el. A korrinvázas vegyület középpontjában kobalt(III)-atom található, ami a gyűrű nitrogénjeihez egy kovalens és három
koordinatív kötéssel kapcsolódik. A korrinváz nem teljesen síkalkatú, mivel a folytonos konjugáció csak 13 atomra terjed ki. A kobaltatomhoz a négy nitrogénatom síkjára merőlegesen felülről egy ciáncsoport kapcsolódik kovalens kötéssel, alulról pedig a benzimidazolgyűrű nitrogénjével létesít koordinatív kötést. 100 O H2N C CH2 CH2 CH3 O H3C C H2N C CH2 H3C O H H2N C CH2 N CN O H3C N CH Co N N CH2 C NH2 O H CH2 CH2 C NH2 CH3 O H C H CH3 O C CH2 CH2 CH3 CH3 CH2 CH2 C NH2 NH O CH3 CH2 CH O N P CH3 OH O O N CH3 HO CH2 O B12-vitamin (cianokobalamin) A B12-vitamin biológiailag aktív formájában a ciáncsoport helyett adenozintrifosztát kapcsolódik a kobaltatomhoz. Imidazol gyűrűt tartalmazó aminosav az L-hisztidin: -(4-imidazolil)-L-alanin O N N H OH enzim N CO2 N H NH2 NH2 hisztamin A hisztamin a hajszálereket tágítja, serkenti a simaizom működést. Allergiás tüneteknél nagy mennyiségben kerül a szövetnedvekbe.
Hisztamint tartalmazó vagy hisztamint felszabadító élelmiszerek: - halak: tonhal, szardínia, szardella, füstölt hering, ikra - érett sajtok: ementáli, camembert, rokfort, stilton, gouda, cheddar, minden penészes és füstölt sajt - alkoholok: vörösbor, fehérbor, pezsgő, sör, - húsfélék: érlelt kolbász, sonka, szalámi, füstölt hús, sertéshús - zöldségek, gyümölcsök: spenót, borsó, lencse, bab, savanyú káposzta, paradicsom, ketchup, eper, papaya, ananász, szója, mák, mogyoró, mogyorókrém - egyéb: tojásfehérje, csokoládé, fahéj, sörélesztő. Az álallergia oka: Egészséges emberekben a hisztamint a máj lebontja, normális körülmények közt a hisztamintakár nagyobb adagok bejutása esetén is képes lebontani szervezetünk. Súlyos problémát csak azoknál okoz, akiknek szervezete erre nem képes - ilyenkor az élelmiszerrel bevitt hisztaminmennyiség hisztaminmérgezést eredményez. Ha valakinek a szervezete már igen csekély
mennyiségre allergiás tünetekkel reagál, akkor szervezetéből hiányzik az az enzim (diaminoxiáz), amely lebontja a hisztamint. Ennek hiányában a fehérjéből és a hisztamindús élelmiszerekből származó hormonszerű anyag nagymértékben felhalmozódik a vérben. Heves, allergiaszerű tünetek jelennek meg, anélkül, hogy az immunrendszer valójában részt vett volna a panaszok kialakulásában (a vizsgálatok IgE ellenanyag- és 101 eozinofil fehérvérsejt-felszaporodást nem mutatnak). Ezért nevezik az állapotot pszeudovagy álallergiának A tüneteket többnyire valamilyen gyógyszer, élelmiszer-adalékanyag, vegyszer vagy konzerválószer (szalicilsav, benzoesav) váltja ki. Amidazophen: fájdalom- és lázcsillapító Gombamérgek Muszkarinszindróma: Amanita muscaria (légyölő galóca), Clytocibe (fehér tölcsérgomba), Inocybe (susulyka) (hallucinogének). Clytocibe Inocybe Amanita muscaria 102 Hattagú, oxigéntartalmú heterociklusok O O
piriliumion O benzpirilium O O O O piron benzpiron (kromon) Pirán-származékok Me OH HO Me Me O Me O Tokoferol (E-vitamin) Hasis (marihuana) vadkender Cannabis sativa Az emberben a tokoferol hatása kevéssé ismert, hiánya nem okoz jellemző tüneteket. A tokoferolok könnyen oxidálódnak, miközben antioxidáns hatást fejtenek ki, így megakadályozzák a többszörösen telítetlen zsírsavak oxidációját. Biológiailag a D-alfatokoferol a leghatásosabb E-vitaminban gazdagok a növényi olajok, zöldnövények, gabonamagvak, de főleg a csíráztatott magvakból nyert olajok. Flavonoidok hidroxilcsoportokat tartalmazó fenilkromán-származékok, melyek szabad, illetve glikozidjaik formájában fordulnak elő a növényvilágban 103 OH HO O Odiglikozid O OH OH rutin (P-vitamin) (aglikon = kvercetin) Hajdina (Fagopyrum esculentum) flavus = sárga (latin); erek permeabilitását befolyásolja (vérzékenység) (OH)n: 640 db. (OH)n(OCH3): 38627
db. OsteochinR (Chinoin) = 7-izopropiloxiizoflavon (csontritkulás előrehaladását csökkenti) O Ph O O Osteochin Flavin 7: A Flavin 7 termékek tartalma: flavonoidok (kvercetin, rutin, miricetin, kempferol, izoramnetin, malvidin-3-glükozid, katechin, krizin, galangin, apigenin, fizetin, luteolin, morin és sok más, kisebb mennyiségben előforduló flavonoid), rezveratrol (transz-, cisz-, valamint ezek glükozidjai), egyéb, az alapanyagul szolgáló gyümölcsökben található növényi antioxidánsok, vitaminok, ásványi anyagok, nyomelemek. A Flavin 7 összetevõi: 7 féle gyümölcsbõl készül, vörösszõlõ feketeszeder, feketecseresznye, feketeribizli, pirosribizli, szilva, alma. Minimális alkoholtartalma is van. Rezveratrol Antocianinok glikozidok, hidrolízisük antocianidineket és cukrokat eredményez. A növények színét adják. OH OH OH HO O Cl cianidin-klorid (vörös) OH OH OH HCl HO O O OH kék O 104 A piros muskátli, szegfű,
ha bázikus talajba kerülnek, kékek lesznek. Hattagú, nitrogéntartalmú heterociklusok Piridinszármazékok O O COOH ox. N Me N (-) nikotin C N N nikotinsav nikotinsav-amid C NH NH2 NH2 N izonikotinsav-hidrazid OH HO b a N 2 1 kinolin benzo[b]piridin 1-azanaftalin OH Me N piridoxin (B6 vitamin) Kötésrendszer 0,140 nm N 2 0,139 nm N N N 0,134 nm c 10 b a N izokinolin benzo[c]piridin 2-azanaftalin 0,967 +0,17 +0,05 +0,05 N -0,57 (h12h21h312pz1) 1,004 N 0,998 1,048 elektronsûrûség sp = 2,21 D Stab. energia: 146,65 kJ/mol k: SE -helyzet < benzol SN -helyzet (Csicsibabin reakció) Bázicitás: A nitrogén sp2 hibridállapota miatt nagyobb az s orbitál hányad, az elektronok nagyobb magvonzás alatt állnak, ezért a piridin gyengébb bázis, mint a tercier amin. Savmegkötőként alkalmazzák a szerves kémiai szintézisekben. pKb N N N 4,2 8,8 H ox. (persav) N Pd(C) / H2 vagy Fe / AcOH MeI / N N I
O Me piridin-N-oxid N-metilpiridinium-jodid terc-aminra utaló kvaternizálás Papaverin: izokinolinszármazék 105 A mák (Papaver somniferum) egyik alkaloidja spazmolitikum (simaizom görcsoldó) MeO N MeO CH2 MeO MeO No-spa: görcsoldó készítmény (Chinoin) MeO MeO N Piridoxin (adermin, B6-vitamin) hiánya patkányon bőrgyulladást okoz rizskorpa, élesztő tartalmazza OH H CH HO OEt OH Me op. 136oC N OEt Piperidin származékok Fentanyl: fájdalomcsillapító, enyhe narkotikum O N N [N-fenil-N-(1-feniletil-4-piperidil)]propionsav-amid Piperin: a bors tartalmazza, transz-transz izomer, cisz változata a kavicin, ami a bors csípős ízéért felelős. O C N O O O O C N O piperin kavicin 106 Hosszabb állás után, a bors elveszti csípős ízét, mert a kavicin a stabilabb piperinné izomerizálódik. Feketebors (Piper nigrum) Hattagú, két nitrogénatomot tartalmazó heterociklusok 3 1 2 2 N N N N 1 piridazin
1,2-diazin N N 3 N N pirimidin 1,3-diazin pirazin 1,4-diazin SE N sp2 (h12h21h312pz1) N " ' ' N N SN pKb: 12,7 (piridin 8,8) az elektronfelhő erősen torzult Pirimidinszármazékok biológiai tulajdonságai 1. Az uracil, timin, citozin a nukleinsavak építőkövei O O OH NH CH3 O N O H barbitursav N uracil O N O timin (5-metiluracil) NH2 NH2 N N N NH N NH H OH OH O CH3 N N OH 2,4-dihidroxipirimidin N OH citozin N H O 107 2. B1-vitamin (aneurin = tiamin-hidroklorid): szénhidrát anyagcsere, főbb energiaszolgáltató folyamatok, idegek működése, idegrendszer energiaellátása, szívműködés Cl N Me Me OH N N NH3 Cl S 3. A barbitursav 5,5-diszubsztituált származékai bénítják az idegrendszert Az adagolástól, alkalmazástól (perorális vagy intravénás) függően altató-, nyugtatóhatást vagy narkózist idéznek elő OH N HO N OH Et Et OH N HO Veronál Et Ph N OH Luminal
Néhány ismert barbiturát „rajongó”: Ryunosuke Akutagawa – japán író, (“Az éneklő borz”) barbiturát túladagolás következtében halt meg (öngyilkosság), július 24, 1927. Adolf Hitler - metamfetamin és kokain élvező volt, barbiturátokat szedett alvászavar ellen. Judy Garland véletlen barbiturát túladagolásban halt meg. Marilyn Monroe, George Sanders: amerikai színészek is. Jimi Hendrix: barbiturát túladagolás és hányás belélegzése Johnny Cash: túlzásba vitte a barbiturátok szedését karrierje csúcsán Elvis Presley: utolsó éveiben sok barbiturátot szedett, de vitatott, hogy ez hozzájárult volna a halálához Margaux Hemingway: amerikai színésznő, az író unokája, fenobarbitál túladagolásban hunyt el Pier Angeli: színésznő, 1971 Jean Seberg: színésznő, Párizs, 1979, mindketten barbiturát túladagolás 4. A szulfapirimidinek baktericid szerek: R N H2N SO2 HN N Szulfaguanidin
(R, R' = H, Me) Szuperszeptil (R,R' = Me) R' 108 Purinvázas vegyületek Purin = imidazo[4,5-d]pirimidin E. Fischer régi képlete: 1N 6 CH 7 2 C 5 C NH a d CH 8 3N C N b c 9 4 H H N N N N HO N purinváz N HO OH N H O H N N N N O Me koffein 1,3,7-trimetilxantin Kávécserje (Coffea arabica) N H2N N H guanin 2-amino-6-OHpurin O Me N Me N O Me teobromin 3,7-dimetilxantin N N adenin 6-aminopurin N N N H O Me N N N húgysav 2,6,8-triOHpurin O Me N H xantin 2,6-diOHpurin OH NH2 N N N N OH N N N N H OH H N N N N Me H teofillin 1,3-dimetilxantin Teacserje (Thea sinensis) 109 Nukleinsavak 1865-ben egy brüni (Brno) apátságban magányosan kertészkedő szerzetes, Gregor Mendel néhány kvantitatív következtetést von le borsókeresztezési kísérleteiből, és ezzel anélkül, hogy tudna róla - megalapozza korunk talán legfontosabb tudományát, a genetikát. Felismerései annyira újszerűek, hogy
noha dolgozatát kora egyik vezető biológusának is elküldi, azok nyomtalanul és visszhangtalanul süllyednek el, amíg 1900-ban hárman (DeVries, Correns, Tschermak) újra fel nem fedezik őket. Négy évvel Mendel dolgozata után, 1869-ben, egy bázeli katonaorvos, Friedrich Miescher sebesült katonák gennyel átitatott kötéseiből izolál és ír le egy új, foszfortartalmú, nagymolekulájú szerves anyagot, amelyet nukleinnek nevez el (ma DNS-nek hívjuk). Ez a felfedezés is meglepő, olyannyira, hogy a kor biokémikus pápája, Hoppe-Seyler két évig visszatartja a közleményt, amíg saját maga meg nem ismétli Miescher kísérleteit, így meggyőződvén azok hitelességéről. Gregor Mendel (1822-1884) Friedrich Miescher (1844-1895) Nagy tömegű, polimer vegyületek, az élő szervezetben a genetikai információ tárolását és a peptidek, valamint a fehérjék bioszintézisét irányítják. A nukleinsavak építőkövei A különféle sejtekből nyert
nukleinsavak teljes hidrolízisével pentózokat, purin- és pirimidinbázisokat, valamint foszforsavat lehet izolálni. Építőegységek: nukleotidok = szerves bázis + cukor + foszforsav nukleozidok = cukor + szerves bázis 110 nukleoprotein (protamin + nukleinsav) hidrolízis (víz) nukleinsavak RNS / DNS (polimer) fehérje (protamin) hidrol. nukleotidok (monomer) hidrol. (OH ) nukleozidok H3PO4 hidrol. (H3O ) 5 HO pirimidin és puringyûrûs vegyületek O NH2 Me NH O uracil U RNS N NH 2 timin T DNS N N citozin C RNS / DNS N HN NH N D-ribóz 2-dezoxi-Dribóz O NH2 NH O OH R OH HN HN 1 3 O O O 4 pentózok H2N NH N adenin A RNS / DNS guanin G RNS / DNS Nukleozidok szerkezete (N-glikozidok) RNS ribonukleozidok NH2 6 N1 7 N 8 HO N 9 O N 3 2 O N HO adenozin 9-(-D-ribofuranozil)adenin guanozin 9-(-D-ribofuranozil)guanin NH2 1N O O HO OH 6 N 3 N OH OH OH OH N O NH O 5 4 OH citidin
3-(-D-ribofuranozil)citozin HN O O HO OH N OH uridin 3-(-D-ribofuranozil)uracil NH2 R OH H 111 DNS dezoxiribonukleozidok NH2 N 5' HO N O 4' 3' OH 2' O N N HO N N O NH2 OH dezoxiguanozin 9-(2'-dezoxi--D-ribofuranozil)guanin O NH2 Me HN N O O N 1' dezoxiadenozin 9-(2'-dezoxi--D-ribofuranozil)adenin HO NH N HO O O N OH OH dezoxicitidin 3-(2'-dezoxi--D-ribofuranozil)citozin timidin 3-(2'-dezoxi--D-ribofuranozil)timin Ha a timidinben a 3’-OH = N3 (azidocsoport) „AZT” (AIDS vírus szaporodását csökkenti)) Zidovudine Nukleinsavak primer szerkezete A polinukleotid láncban a láncvégeken csak az egyik hidroxilcsoport észteresített. A tapasztalat szerint P-terminális az 5’-helyzetben van észteresítve, míg az O-terminális (vagyis a szabad hidroxilcsoport) 3’-OH csoport. Formailag úgy tekinthető a polinukleotidlánc, hogy bennük a nukleozid-5’-foszfátok
acilezik egymást a 3’-helyzetű hidroxilcsoportokon keresztül. DNS-molekulákban általában nincs szabad láncvég, gyűrűvé záródnak össze a láncvégek. A polinukleotidlánc alapváza a polifoszforsav-diészter makromolekula, mely pentózfoszfát összekapcsolással alakul ki. 112 2 1 HO N O pentóz O P O 3 N O pentóz O P O OH n N pentóz O O N O pentóz O P OH OH OH O-terminus P-terminus A polinukleotid lánc primer szerkezete O 5’-vég felé HO O timin H3C O P NH O O N CH2 O H H H H O O O P adenin NH2 N pK=3,8 N O N CH2 O H H H H O O P O N pK=4,5 NH2 N citozin O N CH2 O H H H H O O P O O guanin O N NH O N CH2 O H H H H OH 3’-vég felé N pK=2,4 9,4 NH2 Nukleinsavak másodlagos szerkezete Watson és Crick, 1953 a nukleinsavak szerkezetére tettek javaslatot: két lánc, spirális, egyetlen tengely köré csavarodva, jobbraforgó spirál, de a molekulák a két láncban ellentétes irányban haladnak. A két
láncot purin- és pirimidin-bázisok kapcsolják össze A bázisok 113 síkja merőleges a fonal tengelyére. Párokban kapcsolódnak, az egyik lánc bázisa hidrogénhíddal kötődik a másik lánc bázisához. Az egyik purin kell legyen, a másik pirimidin ahhoz, hogy a kapcsolódás kialakulhasson. A feltételezett specifikus párosodás a genetikai anyag lehetséges másoló mechanizmusára utal. A és T, valamint a G és C hidrogénkötéssel kapcsolódhatnak össze, így a bázisokhoz kötődő dezoxiribóz molekulák csaknem azonos távolságra kerülnek egymástól (~ 11 angström) o 2.8 A H N H O N H N o 2.9 A Me N H N N N N O cukor A N H N N H O N N cukor o 11.1 A H N O N cukor cukor H o 10.8 A T G C Azonos típusú bázisok között nem tud kialakulni stabilis hidrogénkötés, másrészt a cukormolekulák túl messze, vagy túl közel lennének egymáshoz. H H N H N N O N H N N N o 13.5 A A N H N O O cukor H cukor Me N N
N H N cukor O N H N cukor o 8.5 A G C túl hosszú T túl rövid A purin- és pirimidinbázisok eltérő kapcsolódása (pl. A-C) sem jöhet létre, mivel így nem tudna kialakulni stabilizáló hidrogénkötés. H H N H N N N H N N N N O cukor A cukor C 114 A kettős spirál szerkezete A DNS önreprodukciója: DNS-polimeráz enzim hatására szétcsavarodik, és ezzel párhuzamosan megindul a komplementer szál képződése. Ez dezoxiribonukleozid-5’-foszfátból képződik úgy, hogy két szomszédos nukleozid-trifoszfát között - pirofoszforsav lehasadással – az enzim foszforsavdiészter kötést hoz létre. Az eredeti bázishoz hidrogénkötéssel kapcsolódik a komplementer bázis, és így kialakul az új kettős hélix. 115 Az RNS szerkezete Egy szálból épül fel, rövidebb nukleotid láncot tartalmaz. A fehérje szintézisért felelős




