Please log in to read this in our online viewer!
Please log in to read this in our online viewer!
No comments yet. You can be the first!
What did others read after this?
Content extract
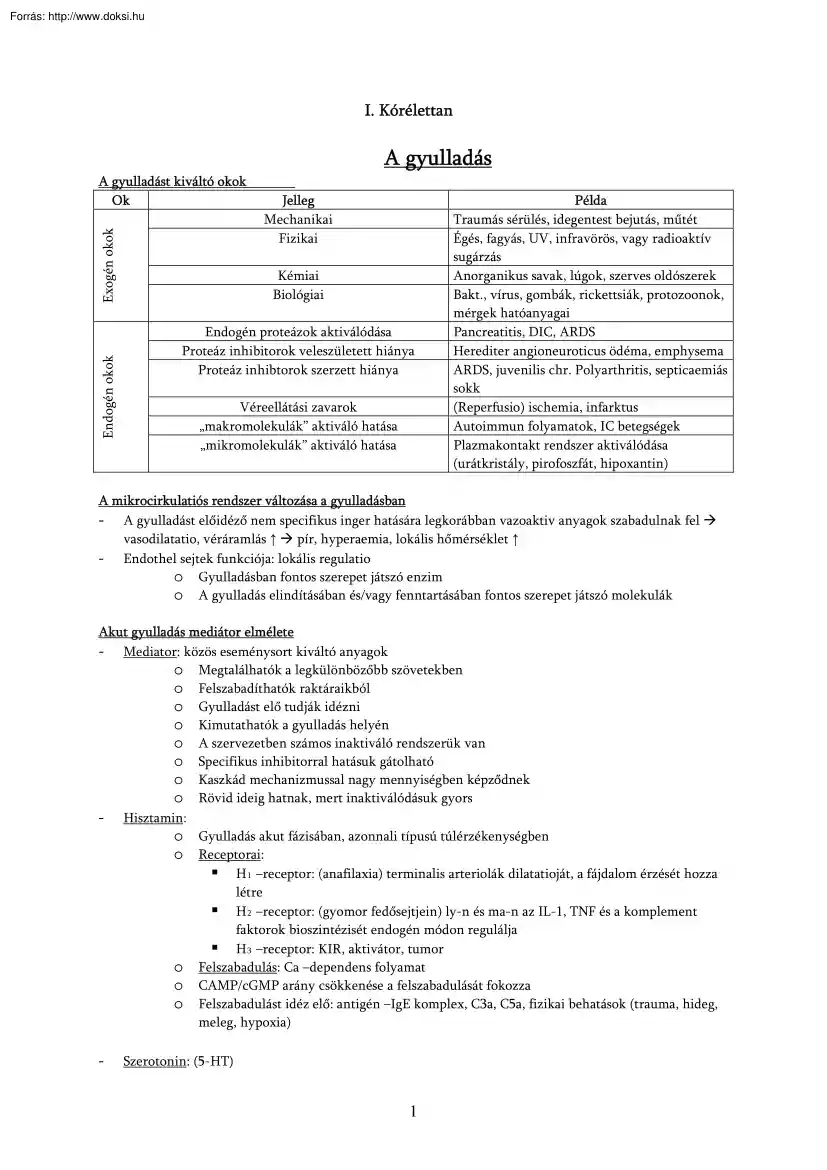
I. Kórélettan A gyulladás Endogén okok Exogén okok A gyulladást kiváltó okok Ok Jelleg Mechanikai Fizikai Kémiai Biológiai Endogén proteázok aktiválódása Proteáz inhibitorok veleszületett hiánya Proteáz inhibtorok szerzett hiánya Véreellátási zavarok „makromolekulák” aktiváló hatása „mikromolekulák” aktiváló hatása Példa Traumás sérülés, idegentest bejutás, műtét Égés, fagyás, UV, infravörös, vagy radioaktív sugárzás Anorganikus savak, lúgok, szerves oldószerek Bakt., vírus, gombák, rickettsiák, protozoonok, mérgek hatóanyagai Pancreatitis, DIC, ARDS Herediter angioneuroticus ödéma, emphysema ARDS, juvenilis chr. Polyarthritis, septicaemiás sokk (Reperfusio) ischemia, infarktus Autoimmun folyamatok, IC betegségek Plazmakontakt rendszer aktiválódása (urátkristály, pirofoszfát, hipoxantin) A mikrocirkulatiós rendszer változása a gyulladásban - A gyulladást előidéző nem specifikus inger hatására
legkorábban vazoaktiv anyagok szabadulnak fel vasodilatatio, véráramlás ↑ pír, hyperaemia, lokális hőmérséklet ↑ - Endothel sejtek funkciója: lokális regulatio o Gyulladásban fontos szerepet játszó enzim o A gyulladás elindításában és/vagy fenntartásában fontos szerepet játszó molekulák Akut gyulladás mediátor elmélete - Mediator: közös eseménysort kiváltó anyagok o Megtalálhatók a legkülönbözőbb szövetekben o Felszabadíthatók raktáraikból o Gyulladást elő tudják idézni o Kimutathatók a gyulladás helyén o A szervezetben számos inaktiváló rendszerük van o Specifikus inhibitorral hatásuk gátolható o Kaszkád mechanizmussal nagy mennyiségben képződnek o Rövid ideig hatnak, mert inaktiválódásuk gyors - Hisztamin: o Gyulladás akut fázisában, azonnali típusú túlérzékenységben o Receptorai: H 1 –receptor: (anafilaxia) terminalis arteriolák dilatatioját, a fájdalom érzését hozza létre H 2
–receptor: (gyomor fedősejtjein) ly-n és ma-n az IL-1, TNF és a komplement faktorok bioszintézisét endogén módon regulálja H 3 –receptor: KIR, aktivátor, tumor o Felszabadulás: Ca –dependens folyamat o CAMP/cGMP arány csökkenése a felszabadulását fokozza o Felszabadulást idéz elő: antigén –IgE komplex, C3a, C5a, fizikai behatások (trauma, hideg, meleg, hypoxia) - Szerotonin: (5-HT) 1 o Thrombocytákban o Felszabadulása: thrombocyta aggregáció alkalmával o Hatása: postkapillaris venulák permeabilitása ↑ - A gyulladás vázlata: Gyulladás tünetei Pir, oedema, meleg, fájdalom Akut fázis válasz Akut gyulladás megszűnése Súlyos akut gyulladás megszűnése Funkció károsodása Krónikus sebgyógyulás Sebgyógyulása Fibrosis Nem specifikus inger következményei Vazoaktiv anyagok felszabadulása Arteriola tágulat, venulák permeabilitásanő Adhéziós molekulák expressziója, thrombocyta aggregáció, leukociták
kitapadása Kemotaktikus anyagok felszabadulása, komplement aktiválódás, NG aktiválódás, ölő mechanizmusok Kemotaxis, komplement aktiválódás, NG migráció és aktiválódás ↓, ölő mechanizmusok ↑ Monocyta/ma migráció és aktiválódás, ölő mechanizmusok, MHC expresszió T-ly aktiválódás, sejt-, szövetkárosodás, fibroblast proliferatio Fibroblast proliferatio, EC mátrix szintézis Endothelsejt proliferatio, angiogenesis Gyulladás szakaszai Mediátorok Alteráció Hisztamin, 5-HT, PG-k, LT-k + IL-1, IL-6, IL-11, TNF Vascularis IL-1, IL-6, Il-11, TNF, PAF, lipoid mediátorok, CSF-k Hisztamin, kemotaktikus peptidek, CSF-k, citokinek, PAF, PDGF, TGF-β Cellularis Sok citokin, PDGF, TGFβ, FAF, bFGF, LDCFF, EGF Gyógyulás A fehérjerendszerek jelentősége gyulladásban - Azonnali védelmet nyújtanak a behatás ellen: o Plazma kontakt aktiválódó rendszere o Komplement rendszer o Fibrinolízis o Véralvadás extrinsic mechanizmusa o
Immunglobulinok Plazma kontakt aktiválódó rendszere: - Aktiválódást elindítja: o Erek basalis membránja o Thrombocyta aggregátum o Bakterialis lipopoliszacharidok o Húgysavkristály o Hosszú szénláncú zsírsavak, mint felületaktív anyagok - Kemotaktikus peptidek, lipoid mediátorok, IL-1, IL-6, IL-8, TNF, CSF-k Fehérjék: 2 PDGF, TGF-β, IL-1, TNF 1. Hageman –faktor (HF) o o o o Zimogén szerin –proteáz β-HFa Aktiválódás: kallikrein, plazmin, aktyv IX. faktor proteolitikus hatására Hatás: aktiválja a prekallikreint, véralvadás XI. és VII faktorát, plazminogént, komplement klasszikus útját Hiányozhat: congenitalisan, szerzetten 2. prekallikrein (Pk) o o Zimogén szerin –proteáz kallikrein Hatása: aktiválja a HF-t, HMWK-t hasítja bradikinin szabadul fel 3. nagy- és kis molekulatömegű kininogén (HMWK és LMWK) o o o o o Plazmakininek: Bradikinin Kallidin (lizin –bradikinin) Metionin –lizin
-bradikinin Hatásuk: Hatásos értágítók hyperaemiás reakció Endothelsejtek kontrakciója gyulladásos ödéma Fájdalom potenciálja más mediátorok (hisztamin, PGE 2 , 5-HT) hyperalgasiás hatását Simaizom kontrakció bronchospasmus Bradikinin stimulálta jelátvivők: Arachidonsav –kaszkád termékei Interleukinok NO Thrombocyta aggregáló faktor (PAF) Tumor necrosis faktor (TNF) Bradikinin inaktiválása: Kinináz I ( membránhoz kötött karboxipeptidáz N) Karboxipeptidáz M Kinináz II ( membránhoz kötött peptidil-peptidáz) A thrombocytákhoz kötött HMWK nem hozzáférhető a thrombosis hajlam csökkent, mert a thrombocyták receptorai HMWK-val fedettek 4. véralvadás XI faktora Szerin -proteáz XIa Aktiválja: HF –faktor limitált proteolízissel Hatása: IX. faktor aktiválása HMWK-hoz és Pk-hoz kötött HF aktiválása Plazminogén plazmin átalakulás -
Szabályozása: túlműködés ellen proteáz inhibitor rendszer Neve Hatásai Hiánybetegségek C 1 –inhibitor (C 1 -INH) Gátol: HFa, plazmakallikreint, XIa, Cong.: herediter angioneuroticus plazmint ödéma Szerzett: septicaemiás sokk, ARDS Szerzett: sokk, ARDS (fokozott Alfa 2 -makroglobulin (α 2 -M) Inaktivál: kallikreint, thrombint, felhasználás miatt) HFa-t, Zn/Cu dependens proteázokat, kollagenázokat, szerin –proteázt, elasztázt Antithrombin III (AT III) Gátol: thrombin, plazmakallikrein, Cong.: fokozott thrombosis XIa, plazmin, HFa készség Szerzett: chr. SZE, malignus tumor Thrombosis hajlam!!! o o o 3 Alfa 1 –proteáz –inhibitor Alfa 1 –tripszin –inhibitor Gátol: tripszin, XIa, thromboplastin, fagocitáló sejtek proteázai Alfa 2 –plazmin –inhibitor Gátol: plazmin Protein C inhibitor Gátol: szöveti kallikreint Cong.: emphysema, bronchiectasia Szerzett: májcirrhosis, juvenilis chr. polyartheritis, chr pancreatitis Cong. Szerzett:
DIC, sokk, ARDS (fokozott felhasználás miatt) Kongenitalis Szerzett: acut pancreatitis, DIC Fokozott thrombosis hajlam!!! Lipoid mediátorok - Eikozanoidoknak nevezzük a ciklooxigenáz enzim hatására arachidonsavból (AA) felszabaduló: o Prosztglandinokat (PGE 2 , PGF 2α , PGD 2 ) o Prosztaciklint (PGI 2 ) o Thromboxánt (TXA 2 ) o Hidroperoxi- és hidroxieikozatetraénsavakat (HPETE-k, HETE-k) o Leukotriéneket (LT) o Lipoxinokat o Epoxieikozatrién savakat - Prekurzorok: sejtmembrán foszfolipoidjaiban és a trigliceridekben - Szabad AA mennyiségét meghatározó enzimek: o Felszabadításban: foszfolipáz A 2 (FLA 2 ), FLC, FLD, diacilglicerinlipáz, lizofoszfolipid aciltranszferáz, foszfatidsav specifikus FLA 3 o Reacilálásban: acil –CoA-szintetáz, lizofoszfolipoid aciltranszferáz - Foszfolipázok aktiválódása Ca –dependens folyamat - FLA 2 inaktivátora: lipokortin –1,2,5 - Arachidonsav termékek képződése és biológiai hatásaik: Lizofoszfolipoidok
Sejtmembránban foszfolipoidok Lipokortin Foszfolipázok PAF Oedema, neutropenia, simaizom kontrakció, kemotaxis, chemokinesis Arachidonsav Ciklooxigenáz PGE 2 , PGI 2 , PGD 2 Lipoxigenáz 5-lipoxigenáz 5 -HPETE Oedema, hyperalgasia, ↓ ly aktivitás, thrombocyta aggregatio gátlása TXA 2 Thrombocyta aggregáció, simaizom kontrakció, cAMP szintézis gátlása - Lipoxin B ↑ leukocyta kemotaxist, kemokiene sist, killing –et, TXA 2 szintézist Lipoxin A NK –sejt citotoxikus gátlása, O 2 –dependens és independens killing ↑ LTA-4 LTB4 Lipoxinok LTC4, D4, E4 (SRS-A) Oedema, simaizom kontrakció, bőrér dilatatio, bronchusban mucin term. ↑, mucocilliaris mozgás gátlása, TXA 2 szintézis ↑ Prosztaglandinok a gyulladásban: 4 o o „Két mediátor” elmélet: PGE 2 , PGD 2 és a PGI 2 okozza a prekapillaris arteriolák tágulatát microcirkulációs véráramlás ↑ Második mediátorok: hisztamin, LTB 4 , peptid mediátorok
postkapillaris venulákban a permeabilitás ↑ Hatások: Mediátor Hatása PGE 2 Gyulladásos ödéma, arteriolák dilatatioja VNY ↓, hyperalgasia, a gyulladás modulatora: feed-back ↓ IL-1, IL-6, TNF termelés PGD 2 Gyulladásos ödéma, hyperalgasia PGI 2 Arteriolák dilatatioja VNY ↓, hyperalgasia, leukocyták és thrombocyták cAMP –szintjét ↑ ↓ a fagocita funkció, az adherencia, a marginációs készség, a motalitása és a thrombocytákban elmaradhat az alakváltozás, a kitapadásuk, az anyagaik felszabadulása TXA 2 Intracellularis cAMP ↓ thrombocyta aggregáció, vascularis és légúti simaizom kontrakció - Leukotriének a gyulladásban: o AA-ból lipoxigenázok hatására hidroperoxieikozatetraénsav (HPETE) keletkezik (elnevezés: melyik C-atomon történt a peroxidáció) o A hidroperoxi terméke biológiailag aktív leukotriénekké alakulnak o LTB 4 Számos sejt termeli (NG, eo, monocyta, ma, T-ly stb.) Chemokinetikus,
kemotaktikus Aggregálja a granulocytákat, ma.-okat, monocytákat Fokozza a degranulálódást, a lysosomális enzimek kiszabadulását Ly-k modulátora: elősegíti a T-szuppresszor aktivitást (IF-γ és C3b-receptor szintézis ↑) Tüdőben lokalisan ↑ a TXA 2 szintézist bronchusösszehúzódás o SRS-A: LTC 4 , LTD 4 , LTE 4 Tüdőben lezajló allergiás gyulladásos jelenségek mediátorai o LT-k felelősek asthma bronchialéban a ↑ mucintermelésért és a ↓ mucociliaris mozgásért o Bőrben vasodilatatiot, pulmonalis és coronaria erekben vasokonstrikciót váltanak ki o ↑ a venulák permeabilitását gyulladásos ödéma - Lizofoszfolipoidok: o Számos Ca-dependens folyamat elindítását idézhetik elő - Thrombocyta aktiváló faktor (PAF): o Alkil-éter-lizofoszatidil-kolin o Termeli: ma, ba, NG o Hatása: ↑ a thrombocyták Ca-dependens aggregációs készségét, anyagaik felszabadulását ↑ venulák permeabilitását +
plasmafehérék extravascularis térbe történő kijutását gyulladásos ödéma NG, eo, ma. adhézióját, chemokienezisét, kemotaxisát, aggregációját és szekrétumainak kiürülését segíti Neutrocytopenia, thrombocytopenia Bronchus simaizom kontrakciója asthma bronchiale Vazoaktív mediátorok: hisztamin, 5-HT, plazmakininek, PGE 2 , -D 2 , -I 2 , TXA 2 , LTB 4 , SRS-A, lizofoszfolipoidok, PAF, C3a, C4a, C5a Citokinek a gyulladásban 5 - A citokinek intetcellularis regulator fehérjék Közös jellemzőik: o Glükolizált kismolekulasúlyú fehérjék o Közreműködnek a gyulladásos és immunfolyamatokban o Átmenetileg képződnek o Molárisan nagyon hatásosak o Nagy affinitású receptorokon hatnak (autokrin, parakrin) o RNS és fehérjeszintézist indukálnak o Interakcióban vannak egymással o Transzmodulálják egymás felszíni receptorait o A sejtfunkciót szinergista, additív, és antagonista módon befolyásolhatják o Számos
sejtben képződhetnek (számos név) Citokin Keletkezése, felszabadulása Hatásai Sok hatásában azonos az IL-6-tal és TNF-fel: Akut fázis fehérje szintézis, láz, IL-1 Aktivált T-ly, monocyta, ma, fibroblast, immunregualtio, fokozza termelését + IL-6, ILastrocyta 8, aktivál Akut fázis válasz, T- és B-ly kemotaxisa, IL-6 Monocyta, ma, fibroblast, keratinocyta fibroblast és osteoclast aktiválás, gátolja az erythropoetin képzést, fokozza a foszfolipáz A 2 -t (autoimmun betegsében, myelomában) Aktivált T-ly, perifériás leukocyta, Kemotaktikus, IC Ca –szintet, receptor IL-8 ceratinocyta expressziót ↑, légzési robbanást vált ki, permeabilitást ↑ IL-11 Csontvelő stroma sejtek Hasonlít az IL-6hoz a hatása + fokozza azokat Számos hatása azonos az IL-1-gyel. TNF –α, -β Monocyta, ma, aktivált T-ly, mastocyta Gyulladás vascularis jelenségei, akut fázis válasz, a GM-CSF gátlóanyaga Aktiválja a monocytát, ma-ot, kemotaxis, T- és TGF -β
Monocyta, ma, aktivált T-ly, fibroblast B –ly proliferatio, differenciálódás, fibroblast proliferatiot és aktivitást ↑, IL-3 inhibitora Komplement rendszer alternatív útja: - Aktiválódása: baktériumokból, fertőzött sejtekből felszabadult komplex poliszacharidok és/vagy lipopoliszacharid molekulák (nincs szükség Ig-ra) - Részei: o C3 o Elősegítők: B és D faktorok o Reguláló: I faktor, DAF (lebontást akceleráló faktor), MCP (membrán kofaktor fehérje), CR1 (complement receptor-1) o Stabilizáló: properdin - C3b –függő, önmagát gyorsító kaszkád - Aktiválódás folyamata: o C3 spontán hidrolízis vagy proteázok bontják C3a és C3b o C3b –hez kötődik a B faktor D faktor hasítja: Ba és Bb fragmentre o A keletkező C3bBb = alternatív C3 –konvertáz o Stabilitását a properdin alakítja ki o Az I faktor az MCP-vel és/vagy a CR1-gyel inaktiválja a C3b-t o A DAF és a CR1 a C3b-Bb kötődést gátolja -
Membránkárosodást előidéző komplex: 6 A C5 –konvertázok (akár a klasszikus úton –C4b2b3b -, akár az alternatív úton –C3bBb3b – keletkezett) indítják el a komplement rendszer közös útját membránkárosító komplex kialakul o A membránhoz kötött C5 –konvertázok hasítják a C5 –t: C5a (anafilatoxin) és C5b o C5b a membránhoz kötve marad kapcsolódik a C6, majd a C7 o Receptorként szolgál a C8-nak stabilan kötődik a sejtmembránhoz és limitált sejtlízist indíthat o C9 kapcsolódik teljes citoliktikus aktivitás - Komplement rendszer regulator fehérjéinek abnormalitása és/vagy hiánya Regulátor Komplement aktiválódás zavara Betegség vagy mechanizmus Szindróma C 1 inhibitor Klasszikus út zavara, túlzott C3 Akut, átmeneti bőr és mucosa Herediter vagy szerzett felhasználás membrán ödéma angioneuroticus ödéma I faktor Klasszikus út regulatiojának Pyogen infekciók, zavara, fokozott C3 felhsználás
vasculitisek, GN DAF C3 –konvertáz disszociációja, Komplement mediált Paroxysmalis éjszakai kialakulása ↑ intravascularis hemolízis hemoglobinuria CD59 Gátolja a C7, C8, és C9 kötődését Komplement mediált Paroxysmalis éjszakai a C5b6 komplexhez intravascularis hemolízis hemoglobinuria CR1 C3 -konvertáz gátló Szisztémás lupus erythematosus o A kemotaxis és chemokinesis mechanizmusa - Kemotaxis: a granulocyták és monocyták egyirányú mozgása, amelyet a kemotaxist kiváltó anyagok koncentrációgrádiensének növekedése határoz meg. - Chemokinesis: sejtek céltalanul, de nagyobb sebességgel vándorolnak (nincs kemotaktikus grádiens) - Kemotaktikus anyagok: kemotaxist, chemokinesist kiváltó anyagok o A sejtek mozgását determinálják o Előidézik a gyulladásban résztvevő sejtek aggregációját, lysosomalis enzimjeik kiszabadulását A. Endogén 1) Plazma eredetű kemotaktikus anyagok Komplement rendszer aktiválódása során keletkező:
C3a, C4a, C5a gyulladásos vascularis jelenségek előidézése, cellularis válasz kialakulása Fibrinogén fibrinopeptid B, E, D 2) Sejtben keletkező kemotaktikus anyagok LTB 4 , PAF, IL-1, TNF Gyulladás vascularis jelenségei, granulocyták és ly-k kemotaxisa, Thrombocyta faktor –4(PF-4) NG kemotaxis IL-8 ly, NG kemotaxis Kolónia stimuláló faktorok(CSF) közvetlenül és közvetve vesznek részt a gyulladás cellularis eseményeiben Tetrapeptdek (NG-ból) eo, NG kemotaxis B. Exogén A baktériumok a fehérjeszintézis során az N –terminálishoz N-formil –metionin peptidet használnak (eukariótában nincs!) Formil –metionin –leucisn –fenilalanin a leghatásosabb a leukocyták kemotaxisában, chemokinesisében. Aktiválódásában 7 A fagocitosis mechanizmusa - Fagocitosis: NG-ák, ma-ok, monocyták a kóros partikulumokat kemotaxis útján felismerik, bekebelezik, majd lebontják (felszíni
receptoraikkal felismerik az opszonizáló anyagokat: IgG 1 , IgG 2 , C3b, C3b i , C3d, fibronektin, C-reaktív protein) - O 2 independens baktérium ölő mechanizmusa 1. Neutrophil granulocyta o NG azurofil granulomaiból szabadulnak fel az anyagok a fagocyta vakuolum teljes bezáródása előtt o Savanyú hidrolázok baktériumfal proteoglikán szerkezetét bontják a fagolizoszómán belül (pH 5,5-6,0) o Neutralis proteázok a katepszin G leghatásosabb mikrobicid o Laktoferrin, B 12 –vitamin kötő fehérje DNS –szintézist gátolják az Fe3+ és a B 12 –vitamin megkötésével 2. Macrophag o Nem tartalmaznak ennyi előre elkészült enzimet és gyulladást előidéző/gátló molekulát o Behatásra indukált de novo szintézis biológiailag aktív anyagok 1. lytikus enzimek: lizozim, neutralis proteázok 2. proteázinhibitorok: α 2 –makroglobulin, plazmininhibitor, kallikrein kötő fehérje 3. komplement rendszer: C1, C2, C3, C4, C5 4. kötőfehérjék:
transferrin, transkobalamin II, fibronektin 5. regulátor fehérjék és peptidek: IL-1, IL-6, IL-8, TNF, INF, PDGF, TGF, CSF, kemotaktikus faktorok - O 2 dependens baktériumölő mechanizmus: o Légzési robbanás: a fagocitáló sejtek kemotaktikus és/vagy fagocitózist előidéző hatásra az O 2 fogyasztásukat rendkívüli módon megemelik reaktív oxigén metabolitok képzésére. o O 2 –ből NADPH –oxidáz hatására szuperoxidanion (O-) mieloperoxidáz hatására H2O2 o H 2 O 2 két hatásosabb oxidáló molekula: Oxidált halidok (OC-, OJ-, OBr-): hatásosan és gyorsan oxidálják bármely sejt sejtfalát Superaktív hidroxilgyök (OH.) és szinglet oxigén (1O 2 ): baktericid és oxidáló hatású OH. fagocitáló sejtben a OH é a hipoklorsav reakciójában keletkezik lipoidok peroxidációja membránszerkezet megváltozik + jelátvivő mechanizmusokat is megváltoztatja o Reaktív oxigén metabolitok elleni védelem: Ezek a
metabolitok a környező ép sejteket is károsíthatják A citosol és ECM is rendelkezik védelmi rendszerrel Fiziológiás körülmények között: kis szöveti oxigéntenzió elegendő IC tér védelme: szuperoxidanion semlegesítése: metalloprotein szuperoxid dizmutázok: SOD, Mn-SOD (citosol, mitokondrium), CuZn-SOD (citosol) A SOD közreműködése után: kataláz, glutation peroxidáz Az EC tér védelme sokkal rosssabb: cöruloplazmin, transzferrin, laktoferrin o Reaktív oxigén metabolitok hatásai a gyulladásos mediátorok, kemotaktikus anyagok átalakulására: AA ciklooxigenáz rendszere aktiválódik az oxigén metabolitok hatására gyulladás vascularis fázisa ↑ Lipoxigenáz rendszer aktiválása, PAF cellularis események aktiválódása Oxigén metabolitok csökkentik a LTC 4 és LTD 4 aktivitását (a tioéterkötést sulfoxiddá oxidálják) Kemotaktikus ingert is ↓: a metionint oxidálják 8 - Endogén
ópiát metionin –enkefalint szulfoxid képződéssel inaktiválják fájdalomérzés ↑ A fagocita funkció zavarai: o Lehet szerzett, lehet kongenitalis 1. NG adherenciáját, aggregációját gátolja: Aspirin, alkohol, glükokortikoidok, hemodialízis 2. Chemokinesis, kemotaxis zavara: glükokortikoid kezelés, SLE, diabetes mellitus, influenza, herpes simplex vírus 3. Microbicid aktivitás gátlása: glükokortikoid kezelés, leukémia, neutropeniák, sepsis, diabetes mellitus 4. Specifikus granulum hiánya: kemotaxis zavara, reaktív oxigén metabolitok csökketn képződése, baktericid hatás hiánya 5. Krónikus granulomatosis: NG, monocyták oxidatív metabolizmusa hiányzik hexóz –monofoszfát söntben, NADPH –oxidáz rendszerben zavar Van fagocitózis, de nem működik az O 2 dependens ölő mechanizmus Kemoattraktáns anyagok lebontásának hiánya hosszú ideig fennáll a gyulladás sejtes válasza granuloma képződés 6. Influenza
vírusfertőzés: Mononuklearis fagocyta rendszer zavara Abnormalis kemotaxis 7. HIV fertőzés: a T-ly IF-γ és Fc –receptor expresszióval hozzájárulnak a mononuklearis sejtek fiziológiás működéséhez mononuklearis fagocita rendszer zavara 8. Autoimmun betegségek: aktív SLE, IC-ek lerakódása (itt is a mononuklearis fagocyta rendszer zavara figyelhető meg) A szervezet szisztémás reakciói gyulladásban - Akut fázis válasz: (AFV) a gyulladás helyén keletkező humorális anyagok, neurogén ingerek rövid időn belül lokális és szisztémás reakciókat indítanak el o Lokális történések: vazoaktív anyagok felszabadulása, gyulladás cellularis eseményeinek beindulása citokinek felszabadulása o Generalizált események: láz, leukocytosis, ACTH, glükokortikoid rendszer, komplement és véralvadási szisztéma aktiválódása o Helyreállítja a homeostasist: közreműködik a proteázok, oxigén metabolitok inaktiválásában
eltávolítja a bekerült exogén anyagokat aktiválja az immunrendszert lokalizálja az elváltozást elősegíti a sebgyógyulást - Láz kialakulása: o AFV egyik legfontosabb jelensége o A hőszabályozó központ érzékenységének primer megváltozása következtében kialakult endogén hőszabályozási zavar o Regulált hyperaemia: fokozott hőtermelés, csökkent hőleadás o Lezajlásában szerepet játszik: Endogén pyrogenek (láz kiváltásában szerepet játszó mediátorok) IL-1α és –β, TNF, IF-α és –β, IL-6 Hatásukra a hypothalamicus hőszabályozó kp-ban ↑ a PGE 2 és PGI 2 szintézis ↓ a melegérzékeny neuronok aktivitása + ↑ a hidegérzékeny neuronok működése => szervezet magasabb értékre áll be Folyamat eredménye: hőkonzerválás a hőképzés növelésével és a hőleadás csökkentésével IL-ek és TNF szintézis számos sejtben 9 IL-1 és TNF egymás szintézisét fokozza és
segíti az IL-6 –ot PGE 2 feed-back gátlással csökkenti a citokinek képződését - - Endogén kryogének (láz megszüntetésében szerepet játszó mediátorok) Vasopresszin (AVP) V 1 –receptoron antipiretikus hatás ↓ a lokalis PGE 2 szintézis ↓ a termoregulatios érték Szalicilátok antipiretikus hatása: AVP ↑ és PGE 2 ↓ Alfa –MSH Antipiretikus hatás: PGE 2 szintézist gátolja Gátolja még: akut fázis fehérjék szintézisét, leukocytosist, alvást A gyulladáskor felszabaduló citokinek stimulálják szintézisét = (-) feed back Uromodulin Vesében az IL-1-hez és TNF-hez kapcsolódik regulálja plazma – szintjüket és hatásukat IL-1 és TNF kötő fehérje PGE 2 szintézis csökkentése + egyéb IL-1 dependens folyamat gátlása TNF –szintjét is regulálják Citokinek ovulatio alkalmával kialakuló testhőmérséklet növekedésben ill. napszaki hőmérséklet
változásokban o A megemelkedett testhőmérséklet (38-39 °C) ↑ IL-1, IL-6 és TNF hatását a ly-kon, IL-k és CSF-ok szintézisét, receptor expressziót, humoralis és cellularis immunválaszt. o A megfigyelhető anyagcsere változásokért az AVF különböző jelenségei felelősek Fokozott szénhidrát-a.cs, megnövekedett O 2 felhasználás katekolamin, TSH és tiroxin-szint és hatás Fokozott fehérje lebontás, (-) N-egyenleg ACTH –mellékvesekéreg rendszer fokozott aktivitása Fokozott Na és vízvisszatartás, K ürítés ACTH –kortizon, aldoszteron ↑ Leukocytosis gyulladásban: o Legérzékenyebb reakció: leukocytosis, balra tolt vérkép, gyulladás helyén leukocyta felhalmozódás, thrombocyta aggregáció o Mediátorok: citokinek, CSF-ok o Fokozzák a monocyta –ma, granulocyta sejtképzést, növelik a megakaryocyta proliferatiot, eo-ok kialakulását, B- és T –ly proliferatioját o IL-1, IL-6, TNF leukocyták,
thrombocyták, endothel felszínén kötésre képes molekulák és receptorok expressziója Thrombocyták gyulladásban: o Thrombocyták aggregációjukkal segítik: véráramlás lassulása, leukocyták adhézióját, aggregációját, aktiválódását, a véralvadás folyamatát o Felszíni receptorai: Thrombocyta –thrombocyta interakció EC adhéziós molekulákhoz történő kötődés Thrombocyta –leukocyta kölcsönhatásban o Thrombocyta –leukocyta adhézió: Glükoproteinek: GP IIIb (CD36), GMP-140 (CD62) GP IIIb: Aktivált thrombocytákon, endothelsejteken, monocytákon Trombospondin megkötésére alkalmas (hidat képez a thrombocyták és monocyták között) 10 Ca jelenlétében: thrombocyta –GP IIIb –trombospondin –fibrinogén – GPIIb-GPIIIa receptor –thrombocyta => irreverzibilis thrombocyta aggregatum GMP –140 - - Aktivált thrombocyták és endothelsejtek felszínén Megköti a
leukocytákat átvándorolhatnak az érfalon A GMP –140-et expresszált thrombocytákat a monocyta –ma rendszer távolítja el Alvás, anaemia, izomszövet proteolízis a gyulladásban: o AFV –ben a KIR-ben ↑ IL-1, IL-6 és TNF ↑ lassú hullámú alvás o Alvás védelmet jelent: Csökken a szervezet E felhasználása Szervezet védelmét és helyreállítását célzó folyamatok hatásfoka ↑ o IL-1, IL-6 és TNF izomsejtekben a PGE 2 képzést ↑ cAMP rendszeren keresztül katepszin –B működése ↑ izomszövet proteolízise ↑ felszabadult aminosavak glükoneogenezisbe E képzés o Citokinek étvágytalanság táplálékfelvétel ↓ o A lipoid felhasználás E-nyerésre kisebb, a fehérjék fokozott lebontása és felhasználása figyelhető meg gyulladásban (-) N-egyenleg o Citokinek csontok demineralizatioja ↑ o Citokinek által indukált vashiány anaemia Akut fázis fehérjék szintézise a gyulladásban:
o Akut fázis fehérjék: számos plazmafehérje, amelyek koncentrációja megnő AFV-ben o Szintézise: májban specifikus „gyulladásos” citokinek (TNF-α, IL-1, IL-6, IL-11, LIF) hatására o 1-es típusú akut fázis fehérjék: C3, haptoglobin, hemopexin, szérum amyloid A, α 1 – savanyú glükoproteinek o 2-es típusú akut fázis fehérjék: fibrinogén, thiosztatin, α 1 –antikimotripszin, α 1 – antitripszin, α 2 –makroglobulin o C –reaktív fehérje: Májban szintetizálódik Bakteriális fertőzés opszonin Liganddal kötött állapotban komplement aktiválódás, thrombocyta aggregáció Károsodott sejtmembránhoz kötődve segíti a fagocitózist a helyreállítás során Kötődik az LDL-hez lipoidokhoz kötött toxicus anyagok eltávolítása o Szérum amyloid P komponens: (SAP) Májban képződik Szelektív Ca-kötő fehérje, kötéskor aggregálódik Ca2+ jelenlétében kapcsolódik: fibrillumokhoz,
elaszticus rostokhoz, fibronektinhez, C4 –kötő fehérjéhez fagocitozis és komplement aktiválódás befolyásolása o Szérum amyloid A komponens: (SAA) Májban képződik Nagy affinitással kötődik a HDL-hez, mint apoprotein Fokozza a HDL-hez kötött toxikus molekulák eliminálását Gátolja a T-sejt –dependens antitest képződését (hatástalan a T –independens B –ly működésére) Akut és krónikus gyulladásban is a szintje emelkedett o Fibronektin: Hepatocytákban, endothelsejtben, fibroblastban, monocytában, makrofágban szintetizálódik Kötődhet: fibrin monomerhez, kollagénhez, Gram (+) és (-) bakt.hoz Heparin kötődése konformációs változás számos kötőhely lesz szabad 11 o Cörüloplazmin: o Fokozza: az opszonizációt, fagocitózist, C3b, C1q és Fc –receptorok mobilizálását Proteázok hatására kemoattraktáns peptidfragmentumok szabadulhatnak fel belőle
gyulladás cellularis eseményei Rézszállító A kötött rézzel redoxrendszert képez vas oxidációja (ferrooxidáznak is nevezik) Közreműködik : Ferri –vas mennyiségének lokális jelenlétében Sejtkárosító hatású reaktív oxigén metabolitok kialakulásában Biogén aminok oxidálása (hisztamin, szerotonin, dopamin, acetil –kolin) Az EC tér egyik leghatásosabb antioxidánsa reaktív oxigén metabolitok elleni védelem Transzferrin: o EC tér másik fontos antioxidánsa A cörüloplazmin által átalakított ferri –vasat elszállítja a gyulladás heyléről fémkatalízissel kialakuló oxigén metabolitok szintézisét gátolja A baktériumok és gombák lokális növekedését is gátolja a vas elsszállításával Laktoferrin: szintén a vasat szállítja el a gyulladás helyéről A krónikus gyulladás és a sebgyógyulás kialakulása és jellemzői - Klinikai terminológia: megadja, hogy a folyamat hosszú ideig
tart (hetek, hónapok, évek) - Pathomechanizmusa: o Gyulladást előidéző nem specifikus inger hosszú ideig megmarad o Folyamatosan felszabaduló endogén faktorok meghatározzák a sejtek funkcióit - Az inger krónikus granulomatosus folyamatot idéz elő o A fagocitáló sejtekben károsodott vagy hiányzanak az ölő mechanizmusok o Olyan anyag (mycobacterium, azbeszt, szilikát) kerül a szervezetbe, amelyet a fagociták nem tudnak lebontani - Krónikus gyulladás szakaszai: 1. gyulladásos fázis: endothelsejtek, monocyta –ma rendszer (thrombocyták, NG-ák, ly-ák) 2. proliferatios fázis: kötőszöveti sejtek migrációja, proliferatioja ECM szintézise, endothel –sejtek migrációja, proliferatioja angiogenesis 3. helyreállítás és/vagy a fibrosisos elváltozások kialakulása: a gyulladást kiváltó citokinek további szekréciója sejtmigrációt és a folyamat amplifikációját idézi elő krónikussá válik - Sejtek szerepe krónikus
gyulladásban: o Endothelsejt:IL-1, IL-6, TNF, PDGF, CSF-k, adhéziós molekulák, koagulatios faktorok o Macrophag/monocyta: PDGF, TGF-k, IL-1, IL-6, IL-8, TNF, INF-ek, CSF-ok, BFGF (bázikus fibroblast GF), FAF (fibroblast aktiváló faktor) o Fibroblast: PDGF, IL-1, IL-6, CSF-k, adhéziós molekulák, proteoglikánok o Thrombocyta: PDGF, TGF –β, BFGF, PF4, véralvadási faktorok, adhéziós molekulák, AA kaszkád elemei o NG: reaktív oxigén metabolitok, adhéziós molekulák, enzimek, biokatív lipidek (PAF, AA metabolitok) o T –ly: IL-2, IL-3, IL-4, IL-6, IL-8, IL-9, FAF, INF-γ, LIF (leukémia inhibitor faktor), MCSF, GM-CSF, TGF -β 12
legkorábban vazoaktiv anyagok szabadulnak fel vasodilatatio, véráramlás ↑ pír, hyperaemia, lokális hőmérséklet ↑ - Endothel sejtek funkciója: lokális regulatio o Gyulladásban fontos szerepet játszó enzim o A gyulladás elindításában és/vagy fenntartásában fontos szerepet játszó molekulák Akut gyulladás mediátor elmélete - Mediator: közös eseménysort kiváltó anyagok o Megtalálhatók a legkülönbözőbb szövetekben o Felszabadíthatók raktáraikból o Gyulladást elő tudják idézni o Kimutathatók a gyulladás helyén o A szervezetben számos inaktiváló rendszerük van o Specifikus inhibitorral hatásuk gátolható o Kaszkád mechanizmussal nagy mennyiségben képződnek o Rövid ideig hatnak, mert inaktiválódásuk gyors - Hisztamin: o Gyulladás akut fázisában, azonnali típusú túlérzékenységben o Receptorai: H 1 –receptor: (anafilaxia) terminalis arteriolák dilatatioját, a fájdalom érzését hozza létre H 2
–receptor: (gyomor fedősejtjein) ly-n és ma-n az IL-1, TNF és a komplement faktorok bioszintézisét endogén módon regulálja H 3 –receptor: KIR, aktivátor, tumor o Felszabadulás: Ca –dependens folyamat o CAMP/cGMP arány csökkenése a felszabadulását fokozza o Felszabadulást idéz elő: antigén –IgE komplex, C3a, C5a, fizikai behatások (trauma, hideg, meleg, hypoxia) - Szerotonin: (5-HT) 1 o Thrombocytákban o Felszabadulása: thrombocyta aggregáció alkalmával o Hatása: postkapillaris venulák permeabilitása ↑ - A gyulladás vázlata: Gyulladás tünetei Pir, oedema, meleg, fájdalom Akut fázis válasz Akut gyulladás megszűnése Súlyos akut gyulladás megszűnése Funkció károsodása Krónikus sebgyógyulás Sebgyógyulása Fibrosis Nem specifikus inger következményei Vazoaktiv anyagok felszabadulása Arteriola tágulat, venulák permeabilitásanő Adhéziós molekulák expressziója, thrombocyta aggregáció, leukociták
kitapadása Kemotaktikus anyagok felszabadulása, komplement aktiválódás, NG aktiválódás, ölő mechanizmusok Kemotaxis, komplement aktiválódás, NG migráció és aktiválódás ↓, ölő mechanizmusok ↑ Monocyta/ma migráció és aktiválódás, ölő mechanizmusok, MHC expresszió T-ly aktiválódás, sejt-, szövetkárosodás, fibroblast proliferatio Fibroblast proliferatio, EC mátrix szintézis Endothelsejt proliferatio, angiogenesis Gyulladás szakaszai Mediátorok Alteráció Hisztamin, 5-HT, PG-k, LT-k + IL-1, IL-6, IL-11, TNF Vascularis IL-1, IL-6, Il-11, TNF, PAF, lipoid mediátorok, CSF-k Hisztamin, kemotaktikus peptidek, CSF-k, citokinek, PAF, PDGF, TGF-β Cellularis Sok citokin, PDGF, TGFβ, FAF, bFGF, LDCFF, EGF Gyógyulás A fehérjerendszerek jelentősége gyulladásban - Azonnali védelmet nyújtanak a behatás ellen: o Plazma kontakt aktiválódó rendszere o Komplement rendszer o Fibrinolízis o Véralvadás extrinsic mechanizmusa o
Immunglobulinok Plazma kontakt aktiválódó rendszere: - Aktiválódást elindítja: o Erek basalis membránja o Thrombocyta aggregátum o Bakterialis lipopoliszacharidok o Húgysavkristály o Hosszú szénláncú zsírsavak, mint felületaktív anyagok - Kemotaktikus peptidek, lipoid mediátorok, IL-1, IL-6, IL-8, TNF, CSF-k Fehérjék: 2 PDGF, TGF-β, IL-1, TNF 1. Hageman –faktor (HF) o o o o Zimogén szerin –proteáz β-HFa Aktiválódás: kallikrein, plazmin, aktyv IX. faktor proteolitikus hatására Hatás: aktiválja a prekallikreint, véralvadás XI. és VII faktorát, plazminogént, komplement klasszikus útját Hiányozhat: congenitalisan, szerzetten 2. prekallikrein (Pk) o o Zimogén szerin –proteáz kallikrein Hatása: aktiválja a HF-t, HMWK-t hasítja bradikinin szabadul fel 3. nagy- és kis molekulatömegű kininogén (HMWK és LMWK) o o o o o Plazmakininek: Bradikinin Kallidin (lizin –bradikinin) Metionin –lizin
-bradikinin Hatásuk: Hatásos értágítók hyperaemiás reakció Endothelsejtek kontrakciója gyulladásos ödéma Fájdalom potenciálja más mediátorok (hisztamin, PGE 2 , 5-HT) hyperalgasiás hatását Simaizom kontrakció bronchospasmus Bradikinin stimulálta jelátvivők: Arachidonsav –kaszkád termékei Interleukinok NO Thrombocyta aggregáló faktor (PAF) Tumor necrosis faktor (TNF) Bradikinin inaktiválása: Kinináz I ( membránhoz kötött karboxipeptidáz N) Karboxipeptidáz M Kinináz II ( membránhoz kötött peptidil-peptidáz) A thrombocytákhoz kötött HMWK nem hozzáférhető a thrombosis hajlam csökkent, mert a thrombocyták receptorai HMWK-val fedettek 4. véralvadás XI faktora Szerin -proteáz XIa Aktiválja: HF –faktor limitált proteolízissel Hatása: IX. faktor aktiválása HMWK-hoz és Pk-hoz kötött HF aktiválása Plazminogén plazmin átalakulás -
Szabályozása: túlműködés ellen proteáz inhibitor rendszer Neve Hatásai Hiánybetegségek C 1 –inhibitor (C 1 -INH) Gátol: HFa, plazmakallikreint, XIa, Cong.: herediter angioneuroticus plazmint ödéma Szerzett: septicaemiás sokk, ARDS Szerzett: sokk, ARDS (fokozott Alfa 2 -makroglobulin (α 2 -M) Inaktivál: kallikreint, thrombint, felhasználás miatt) HFa-t, Zn/Cu dependens proteázokat, kollagenázokat, szerin –proteázt, elasztázt Antithrombin III (AT III) Gátol: thrombin, plazmakallikrein, Cong.: fokozott thrombosis XIa, plazmin, HFa készség Szerzett: chr. SZE, malignus tumor Thrombosis hajlam!!! o o o 3 Alfa 1 –proteáz –inhibitor Alfa 1 –tripszin –inhibitor Gátol: tripszin, XIa, thromboplastin, fagocitáló sejtek proteázai Alfa 2 –plazmin –inhibitor Gátol: plazmin Protein C inhibitor Gátol: szöveti kallikreint Cong.: emphysema, bronchiectasia Szerzett: májcirrhosis, juvenilis chr. polyartheritis, chr pancreatitis Cong. Szerzett:
DIC, sokk, ARDS (fokozott felhasználás miatt) Kongenitalis Szerzett: acut pancreatitis, DIC Fokozott thrombosis hajlam!!! Lipoid mediátorok - Eikozanoidoknak nevezzük a ciklooxigenáz enzim hatására arachidonsavból (AA) felszabaduló: o Prosztglandinokat (PGE 2 , PGF 2α , PGD 2 ) o Prosztaciklint (PGI 2 ) o Thromboxánt (TXA 2 ) o Hidroperoxi- és hidroxieikozatetraénsavakat (HPETE-k, HETE-k) o Leukotriéneket (LT) o Lipoxinokat o Epoxieikozatrién savakat - Prekurzorok: sejtmembrán foszfolipoidjaiban és a trigliceridekben - Szabad AA mennyiségét meghatározó enzimek: o Felszabadításban: foszfolipáz A 2 (FLA 2 ), FLC, FLD, diacilglicerinlipáz, lizofoszfolipid aciltranszferáz, foszfatidsav specifikus FLA 3 o Reacilálásban: acil –CoA-szintetáz, lizofoszfolipoid aciltranszferáz - Foszfolipázok aktiválódása Ca –dependens folyamat - FLA 2 inaktivátora: lipokortin –1,2,5 - Arachidonsav termékek képződése és biológiai hatásaik: Lizofoszfolipoidok
Sejtmembránban foszfolipoidok Lipokortin Foszfolipázok PAF Oedema, neutropenia, simaizom kontrakció, kemotaxis, chemokinesis Arachidonsav Ciklooxigenáz PGE 2 , PGI 2 , PGD 2 Lipoxigenáz 5-lipoxigenáz 5 -HPETE Oedema, hyperalgasia, ↓ ly aktivitás, thrombocyta aggregatio gátlása TXA 2 Thrombocyta aggregáció, simaizom kontrakció, cAMP szintézis gátlása - Lipoxin B ↑ leukocyta kemotaxist, kemokiene sist, killing –et, TXA 2 szintézist Lipoxin A NK –sejt citotoxikus gátlása, O 2 –dependens és independens killing ↑ LTA-4 LTB4 Lipoxinok LTC4, D4, E4 (SRS-A) Oedema, simaizom kontrakció, bőrér dilatatio, bronchusban mucin term. ↑, mucocilliaris mozgás gátlása, TXA 2 szintézis ↑ Prosztaglandinok a gyulladásban: 4 o o „Két mediátor” elmélet: PGE 2 , PGD 2 és a PGI 2 okozza a prekapillaris arteriolák tágulatát microcirkulációs véráramlás ↑ Második mediátorok: hisztamin, LTB 4 , peptid mediátorok
postkapillaris venulákban a permeabilitás ↑ Hatások: Mediátor Hatása PGE 2 Gyulladásos ödéma, arteriolák dilatatioja VNY ↓, hyperalgasia, a gyulladás modulatora: feed-back ↓ IL-1, IL-6, TNF termelés PGD 2 Gyulladásos ödéma, hyperalgasia PGI 2 Arteriolák dilatatioja VNY ↓, hyperalgasia, leukocyták és thrombocyták cAMP –szintjét ↑ ↓ a fagocita funkció, az adherencia, a marginációs készség, a motalitása és a thrombocytákban elmaradhat az alakváltozás, a kitapadásuk, az anyagaik felszabadulása TXA 2 Intracellularis cAMP ↓ thrombocyta aggregáció, vascularis és légúti simaizom kontrakció - Leukotriének a gyulladásban: o AA-ból lipoxigenázok hatására hidroperoxieikozatetraénsav (HPETE) keletkezik (elnevezés: melyik C-atomon történt a peroxidáció) o A hidroperoxi terméke biológiailag aktív leukotriénekké alakulnak o LTB 4 Számos sejt termeli (NG, eo, monocyta, ma, T-ly stb.) Chemokinetikus,
kemotaktikus Aggregálja a granulocytákat, ma.-okat, monocytákat Fokozza a degranulálódást, a lysosomális enzimek kiszabadulását Ly-k modulátora: elősegíti a T-szuppresszor aktivitást (IF-γ és C3b-receptor szintézis ↑) Tüdőben lokalisan ↑ a TXA 2 szintézist bronchusösszehúzódás o SRS-A: LTC 4 , LTD 4 , LTE 4 Tüdőben lezajló allergiás gyulladásos jelenségek mediátorai o LT-k felelősek asthma bronchialéban a ↑ mucintermelésért és a ↓ mucociliaris mozgásért o Bőrben vasodilatatiot, pulmonalis és coronaria erekben vasokonstrikciót váltanak ki o ↑ a venulák permeabilitását gyulladásos ödéma - Lizofoszfolipoidok: o Számos Ca-dependens folyamat elindítását idézhetik elő - Thrombocyta aktiváló faktor (PAF): o Alkil-éter-lizofoszatidil-kolin o Termeli: ma, ba, NG o Hatása: ↑ a thrombocyták Ca-dependens aggregációs készségét, anyagaik felszabadulását ↑ venulák permeabilitását +
plasmafehérék extravascularis térbe történő kijutását gyulladásos ödéma NG, eo, ma. adhézióját, chemokienezisét, kemotaxisát, aggregációját és szekrétumainak kiürülését segíti Neutrocytopenia, thrombocytopenia Bronchus simaizom kontrakciója asthma bronchiale Vazoaktív mediátorok: hisztamin, 5-HT, plazmakininek, PGE 2 , -D 2 , -I 2 , TXA 2 , LTB 4 , SRS-A, lizofoszfolipoidok, PAF, C3a, C4a, C5a Citokinek a gyulladásban 5 - A citokinek intetcellularis regulator fehérjék Közös jellemzőik: o Glükolizált kismolekulasúlyú fehérjék o Közreműködnek a gyulladásos és immunfolyamatokban o Átmenetileg képződnek o Molárisan nagyon hatásosak o Nagy affinitású receptorokon hatnak (autokrin, parakrin) o RNS és fehérjeszintézist indukálnak o Interakcióban vannak egymással o Transzmodulálják egymás felszíni receptorait o A sejtfunkciót szinergista, additív, és antagonista módon befolyásolhatják o Számos
sejtben képződhetnek (számos név) Citokin Keletkezése, felszabadulása Hatásai Sok hatásában azonos az IL-6-tal és TNF-fel: Akut fázis fehérje szintézis, láz, IL-1 Aktivált T-ly, monocyta, ma, fibroblast, immunregualtio, fokozza termelését + IL-6, ILastrocyta 8, aktivál Akut fázis válasz, T- és B-ly kemotaxisa, IL-6 Monocyta, ma, fibroblast, keratinocyta fibroblast és osteoclast aktiválás, gátolja az erythropoetin képzést, fokozza a foszfolipáz A 2 -t (autoimmun betegsében, myelomában) Aktivált T-ly, perifériás leukocyta, Kemotaktikus, IC Ca –szintet, receptor IL-8 ceratinocyta expressziót ↑, légzési robbanást vált ki, permeabilitást ↑ IL-11 Csontvelő stroma sejtek Hasonlít az IL-6hoz a hatása + fokozza azokat Számos hatása azonos az IL-1-gyel. TNF –α, -β Monocyta, ma, aktivált T-ly, mastocyta Gyulladás vascularis jelenségei, akut fázis válasz, a GM-CSF gátlóanyaga Aktiválja a monocytát, ma-ot, kemotaxis, T- és TGF -β
Monocyta, ma, aktivált T-ly, fibroblast B –ly proliferatio, differenciálódás, fibroblast proliferatiot és aktivitást ↑, IL-3 inhibitora Komplement rendszer alternatív útja: - Aktiválódása: baktériumokból, fertőzött sejtekből felszabadult komplex poliszacharidok és/vagy lipopoliszacharid molekulák (nincs szükség Ig-ra) - Részei: o C3 o Elősegítők: B és D faktorok o Reguláló: I faktor, DAF (lebontást akceleráló faktor), MCP (membrán kofaktor fehérje), CR1 (complement receptor-1) o Stabilizáló: properdin - C3b –függő, önmagát gyorsító kaszkád - Aktiválódás folyamata: o C3 spontán hidrolízis vagy proteázok bontják C3a és C3b o C3b –hez kötődik a B faktor D faktor hasítja: Ba és Bb fragmentre o A keletkező C3bBb = alternatív C3 –konvertáz o Stabilitását a properdin alakítja ki o Az I faktor az MCP-vel és/vagy a CR1-gyel inaktiválja a C3b-t o A DAF és a CR1 a C3b-Bb kötődést gátolja -
Membránkárosodást előidéző komplex: 6 A C5 –konvertázok (akár a klasszikus úton –C4b2b3b -, akár az alternatív úton –C3bBb3b – keletkezett) indítják el a komplement rendszer közös útját membránkárosító komplex kialakul o A membránhoz kötött C5 –konvertázok hasítják a C5 –t: C5a (anafilatoxin) és C5b o C5b a membránhoz kötve marad kapcsolódik a C6, majd a C7 o Receptorként szolgál a C8-nak stabilan kötődik a sejtmembránhoz és limitált sejtlízist indíthat o C9 kapcsolódik teljes citoliktikus aktivitás - Komplement rendszer regulator fehérjéinek abnormalitása és/vagy hiánya Regulátor Komplement aktiválódás zavara Betegség vagy mechanizmus Szindróma C 1 inhibitor Klasszikus út zavara, túlzott C3 Akut, átmeneti bőr és mucosa Herediter vagy szerzett felhasználás membrán ödéma angioneuroticus ödéma I faktor Klasszikus út regulatiojának Pyogen infekciók, zavara, fokozott C3 felhsználás
vasculitisek, GN DAF C3 –konvertáz disszociációja, Komplement mediált Paroxysmalis éjszakai kialakulása ↑ intravascularis hemolízis hemoglobinuria CD59 Gátolja a C7, C8, és C9 kötődését Komplement mediált Paroxysmalis éjszakai a C5b6 komplexhez intravascularis hemolízis hemoglobinuria CR1 C3 -konvertáz gátló Szisztémás lupus erythematosus o A kemotaxis és chemokinesis mechanizmusa - Kemotaxis: a granulocyták és monocyták egyirányú mozgása, amelyet a kemotaxist kiváltó anyagok koncentrációgrádiensének növekedése határoz meg. - Chemokinesis: sejtek céltalanul, de nagyobb sebességgel vándorolnak (nincs kemotaktikus grádiens) - Kemotaktikus anyagok: kemotaxist, chemokinesist kiváltó anyagok o A sejtek mozgását determinálják o Előidézik a gyulladásban résztvevő sejtek aggregációját, lysosomalis enzimjeik kiszabadulását A. Endogén 1) Plazma eredetű kemotaktikus anyagok Komplement rendszer aktiválódása során keletkező:
C3a, C4a, C5a gyulladásos vascularis jelenségek előidézése, cellularis válasz kialakulása Fibrinogén fibrinopeptid B, E, D 2) Sejtben keletkező kemotaktikus anyagok LTB 4 , PAF, IL-1, TNF Gyulladás vascularis jelenségei, granulocyták és ly-k kemotaxisa, Thrombocyta faktor –4(PF-4) NG kemotaxis IL-8 ly, NG kemotaxis Kolónia stimuláló faktorok(CSF) közvetlenül és közvetve vesznek részt a gyulladás cellularis eseményeiben Tetrapeptdek (NG-ból) eo, NG kemotaxis B. Exogén A baktériumok a fehérjeszintézis során az N –terminálishoz N-formil –metionin peptidet használnak (eukariótában nincs!) Formil –metionin –leucisn –fenilalanin a leghatásosabb a leukocyták kemotaxisában, chemokinesisében. Aktiválódásában 7 A fagocitosis mechanizmusa - Fagocitosis: NG-ák, ma-ok, monocyták a kóros partikulumokat kemotaxis útján felismerik, bekebelezik, majd lebontják (felszíni
receptoraikkal felismerik az opszonizáló anyagokat: IgG 1 , IgG 2 , C3b, C3b i , C3d, fibronektin, C-reaktív protein) - O 2 independens baktérium ölő mechanizmusa 1. Neutrophil granulocyta o NG azurofil granulomaiból szabadulnak fel az anyagok a fagocyta vakuolum teljes bezáródása előtt o Savanyú hidrolázok baktériumfal proteoglikán szerkezetét bontják a fagolizoszómán belül (pH 5,5-6,0) o Neutralis proteázok a katepszin G leghatásosabb mikrobicid o Laktoferrin, B 12 –vitamin kötő fehérje DNS –szintézist gátolják az Fe3+ és a B 12 –vitamin megkötésével 2. Macrophag o Nem tartalmaznak ennyi előre elkészült enzimet és gyulladást előidéző/gátló molekulát o Behatásra indukált de novo szintézis biológiailag aktív anyagok 1. lytikus enzimek: lizozim, neutralis proteázok 2. proteázinhibitorok: α 2 –makroglobulin, plazmininhibitor, kallikrein kötő fehérje 3. komplement rendszer: C1, C2, C3, C4, C5 4. kötőfehérjék:
transferrin, transkobalamin II, fibronektin 5. regulátor fehérjék és peptidek: IL-1, IL-6, IL-8, TNF, INF, PDGF, TGF, CSF, kemotaktikus faktorok - O 2 dependens baktériumölő mechanizmus: o Légzési robbanás: a fagocitáló sejtek kemotaktikus és/vagy fagocitózist előidéző hatásra az O 2 fogyasztásukat rendkívüli módon megemelik reaktív oxigén metabolitok képzésére. o O 2 –ből NADPH –oxidáz hatására szuperoxidanion (O-) mieloperoxidáz hatására H2O2 o H 2 O 2 két hatásosabb oxidáló molekula: Oxidált halidok (OC-, OJ-, OBr-): hatásosan és gyorsan oxidálják bármely sejt sejtfalát Superaktív hidroxilgyök (OH.) és szinglet oxigén (1O 2 ): baktericid és oxidáló hatású OH. fagocitáló sejtben a OH é a hipoklorsav reakciójában keletkezik lipoidok peroxidációja membránszerkezet megváltozik + jelátvivő mechanizmusokat is megváltoztatja o Reaktív oxigén metabolitok elleni védelem: Ezek a
metabolitok a környező ép sejteket is károsíthatják A citosol és ECM is rendelkezik védelmi rendszerrel Fiziológiás körülmények között: kis szöveti oxigéntenzió elegendő IC tér védelme: szuperoxidanion semlegesítése: metalloprotein szuperoxid dizmutázok: SOD, Mn-SOD (citosol, mitokondrium), CuZn-SOD (citosol) A SOD közreműködése után: kataláz, glutation peroxidáz Az EC tér védelme sokkal rosssabb: cöruloplazmin, transzferrin, laktoferrin o Reaktív oxigén metabolitok hatásai a gyulladásos mediátorok, kemotaktikus anyagok átalakulására: AA ciklooxigenáz rendszere aktiválódik az oxigén metabolitok hatására gyulladás vascularis fázisa ↑ Lipoxigenáz rendszer aktiválása, PAF cellularis események aktiválódása Oxigén metabolitok csökkentik a LTC 4 és LTD 4 aktivitását (a tioéterkötést sulfoxiddá oxidálják) Kemotaktikus ingert is ↓: a metionint oxidálják 8 - Endogén
ópiát metionin –enkefalint szulfoxid képződéssel inaktiválják fájdalomérzés ↑ A fagocita funkció zavarai: o Lehet szerzett, lehet kongenitalis 1. NG adherenciáját, aggregációját gátolja: Aspirin, alkohol, glükokortikoidok, hemodialízis 2. Chemokinesis, kemotaxis zavara: glükokortikoid kezelés, SLE, diabetes mellitus, influenza, herpes simplex vírus 3. Microbicid aktivitás gátlása: glükokortikoid kezelés, leukémia, neutropeniák, sepsis, diabetes mellitus 4. Specifikus granulum hiánya: kemotaxis zavara, reaktív oxigén metabolitok csökketn képződése, baktericid hatás hiánya 5. Krónikus granulomatosis: NG, monocyták oxidatív metabolizmusa hiányzik hexóz –monofoszfát söntben, NADPH –oxidáz rendszerben zavar Van fagocitózis, de nem működik az O 2 dependens ölő mechanizmus Kemoattraktáns anyagok lebontásának hiánya hosszú ideig fennáll a gyulladás sejtes válasza granuloma képződés 6. Influenza
vírusfertőzés: Mononuklearis fagocyta rendszer zavara Abnormalis kemotaxis 7. HIV fertőzés: a T-ly IF-γ és Fc –receptor expresszióval hozzájárulnak a mononuklearis sejtek fiziológiás működéséhez mononuklearis fagocita rendszer zavara 8. Autoimmun betegségek: aktív SLE, IC-ek lerakódása (itt is a mononuklearis fagocyta rendszer zavara figyelhető meg) A szervezet szisztémás reakciói gyulladásban - Akut fázis válasz: (AFV) a gyulladás helyén keletkező humorális anyagok, neurogén ingerek rövid időn belül lokális és szisztémás reakciókat indítanak el o Lokális történések: vazoaktív anyagok felszabadulása, gyulladás cellularis eseményeinek beindulása citokinek felszabadulása o Generalizált események: láz, leukocytosis, ACTH, glükokortikoid rendszer, komplement és véralvadási szisztéma aktiválódása o Helyreállítja a homeostasist: közreműködik a proteázok, oxigén metabolitok inaktiválásában
eltávolítja a bekerült exogén anyagokat aktiválja az immunrendszert lokalizálja az elváltozást elősegíti a sebgyógyulást - Láz kialakulása: o AFV egyik legfontosabb jelensége o A hőszabályozó központ érzékenységének primer megváltozása következtében kialakult endogén hőszabályozási zavar o Regulált hyperaemia: fokozott hőtermelés, csökkent hőleadás o Lezajlásában szerepet játszik: Endogén pyrogenek (láz kiváltásában szerepet játszó mediátorok) IL-1α és –β, TNF, IF-α és –β, IL-6 Hatásukra a hypothalamicus hőszabályozó kp-ban ↑ a PGE 2 és PGI 2 szintézis ↓ a melegérzékeny neuronok aktivitása + ↑ a hidegérzékeny neuronok működése => szervezet magasabb értékre áll be Folyamat eredménye: hőkonzerválás a hőképzés növelésével és a hőleadás csökkentésével IL-ek és TNF szintézis számos sejtben 9 IL-1 és TNF egymás szintézisét fokozza és
segíti az IL-6 –ot PGE 2 feed-back gátlással csökkenti a citokinek képződését - - Endogén kryogének (láz megszüntetésében szerepet játszó mediátorok) Vasopresszin (AVP) V 1 –receptoron antipiretikus hatás ↓ a lokalis PGE 2 szintézis ↓ a termoregulatios érték Szalicilátok antipiretikus hatása: AVP ↑ és PGE 2 ↓ Alfa –MSH Antipiretikus hatás: PGE 2 szintézist gátolja Gátolja még: akut fázis fehérjék szintézisét, leukocytosist, alvást A gyulladáskor felszabaduló citokinek stimulálják szintézisét = (-) feed back Uromodulin Vesében az IL-1-hez és TNF-hez kapcsolódik regulálja plazma – szintjüket és hatásukat IL-1 és TNF kötő fehérje PGE 2 szintézis csökkentése + egyéb IL-1 dependens folyamat gátlása TNF –szintjét is regulálják Citokinek ovulatio alkalmával kialakuló testhőmérséklet növekedésben ill. napszaki hőmérséklet
változásokban o A megemelkedett testhőmérséklet (38-39 °C) ↑ IL-1, IL-6 és TNF hatását a ly-kon, IL-k és CSF-ok szintézisét, receptor expressziót, humoralis és cellularis immunválaszt. o A megfigyelhető anyagcsere változásokért az AVF különböző jelenségei felelősek Fokozott szénhidrát-a.cs, megnövekedett O 2 felhasználás katekolamin, TSH és tiroxin-szint és hatás Fokozott fehérje lebontás, (-) N-egyenleg ACTH –mellékvesekéreg rendszer fokozott aktivitása Fokozott Na és vízvisszatartás, K ürítés ACTH –kortizon, aldoszteron ↑ Leukocytosis gyulladásban: o Legérzékenyebb reakció: leukocytosis, balra tolt vérkép, gyulladás helyén leukocyta felhalmozódás, thrombocyta aggregáció o Mediátorok: citokinek, CSF-ok o Fokozzák a monocyta –ma, granulocyta sejtképzést, növelik a megakaryocyta proliferatiot, eo-ok kialakulását, B- és T –ly proliferatioját o IL-1, IL-6, TNF leukocyták,
thrombocyták, endothel felszínén kötésre képes molekulák és receptorok expressziója Thrombocyták gyulladásban: o Thrombocyták aggregációjukkal segítik: véráramlás lassulása, leukocyták adhézióját, aggregációját, aktiválódását, a véralvadás folyamatát o Felszíni receptorai: Thrombocyta –thrombocyta interakció EC adhéziós molekulákhoz történő kötődés Thrombocyta –leukocyta kölcsönhatásban o Thrombocyta –leukocyta adhézió: Glükoproteinek: GP IIIb (CD36), GMP-140 (CD62) GP IIIb: Aktivált thrombocytákon, endothelsejteken, monocytákon Trombospondin megkötésére alkalmas (hidat képez a thrombocyták és monocyták között) 10 Ca jelenlétében: thrombocyta –GP IIIb –trombospondin –fibrinogén – GPIIb-GPIIIa receptor –thrombocyta => irreverzibilis thrombocyta aggregatum GMP –140 - - Aktivált thrombocyták és endothelsejtek felszínén Megköti a
leukocytákat átvándorolhatnak az érfalon A GMP –140-et expresszált thrombocytákat a monocyta –ma rendszer távolítja el Alvás, anaemia, izomszövet proteolízis a gyulladásban: o AFV –ben a KIR-ben ↑ IL-1, IL-6 és TNF ↑ lassú hullámú alvás o Alvás védelmet jelent: Csökken a szervezet E felhasználása Szervezet védelmét és helyreállítását célzó folyamatok hatásfoka ↑ o IL-1, IL-6 és TNF izomsejtekben a PGE 2 képzést ↑ cAMP rendszeren keresztül katepszin –B működése ↑ izomszövet proteolízise ↑ felszabadult aminosavak glükoneogenezisbe E képzés o Citokinek étvágytalanság táplálékfelvétel ↓ o A lipoid felhasználás E-nyerésre kisebb, a fehérjék fokozott lebontása és felhasználása figyelhető meg gyulladásban (-) N-egyenleg o Citokinek csontok demineralizatioja ↑ o Citokinek által indukált vashiány anaemia Akut fázis fehérjék szintézise a gyulladásban:
o Akut fázis fehérjék: számos plazmafehérje, amelyek koncentrációja megnő AFV-ben o Szintézise: májban specifikus „gyulladásos” citokinek (TNF-α, IL-1, IL-6, IL-11, LIF) hatására o 1-es típusú akut fázis fehérjék: C3, haptoglobin, hemopexin, szérum amyloid A, α 1 – savanyú glükoproteinek o 2-es típusú akut fázis fehérjék: fibrinogén, thiosztatin, α 1 –antikimotripszin, α 1 – antitripszin, α 2 –makroglobulin o C –reaktív fehérje: Májban szintetizálódik Bakteriális fertőzés opszonin Liganddal kötött állapotban komplement aktiválódás, thrombocyta aggregáció Károsodott sejtmembránhoz kötődve segíti a fagocitózist a helyreállítás során Kötődik az LDL-hez lipoidokhoz kötött toxicus anyagok eltávolítása o Szérum amyloid P komponens: (SAP) Májban képződik Szelektív Ca-kötő fehérje, kötéskor aggregálódik Ca2+ jelenlétében kapcsolódik: fibrillumokhoz,
elaszticus rostokhoz, fibronektinhez, C4 –kötő fehérjéhez fagocitozis és komplement aktiválódás befolyásolása o Szérum amyloid A komponens: (SAA) Májban képződik Nagy affinitással kötődik a HDL-hez, mint apoprotein Fokozza a HDL-hez kötött toxikus molekulák eliminálását Gátolja a T-sejt –dependens antitest képződését (hatástalan a T –independens B –ly működésére) Akut és krónikus gyulladásban is a szintje emelkedett o Fibronektin: Hepatocytákban, endothelsejtben, fibroblastban, monocytában, makrofágban szintetizálódik Kötődhet: fibrin monomerhez, kollagénhez, Gram (+) és (-) bakt.hoz Heparin kötődése konformációs változás számos kötőhely lesz szabad 11 o Cörüloplazmin: o Fokozza: az opszonizációt, fagocitózist, C3b, C1q és Fc –receptorok mobilizálását Proteázok hatására kemoattraktáns peptidfragmentumok szabadulhatnak fel belőle
gyulladás cellularis eseményei Rézszállító A kötött rézzel redoxrendszert képez vas oxidációja (ferrooxidáznak is nevezik) Közreműködik : Ferri –vas mennyiségének lokális jelenlétében Sejtkárosító hatású reaktív oxigén metabolitok kialakulásában Biogén aminok oxidálása (hisztamin, szerotonin, dopamin, acetil –kolin) Az EC tér egyik leghatásosabb antioxidánsa reaktív oxigén metabolitok elleni védelem Transzferrin: o EC tér másik fontos antioxidánsa A cörüloplazmin által átalakított ferri –vasat elszállítja a gyulladás heyléről fémkatalízissel kialakuló oxigén metabolitok szintézisét gátolja A baktériumok és gombák lokális növekedését is gátolja a vas elsszállításával Laktoferrin: szintén a vasat szállítja el a gyulladás helyéről A krónikus gyulladás és a sebgyógyulás kialakulása és jellemzői - Klinikai terminológia: megadja, hogy a folyamat hosszú ideig
tart (hetek, hónapok, évek) - Pathomechanizmusa: o Gyulladást előidéző nem specifikus inger hosszú ideig megmarad o Folyamatosan felszabaduló endogén faktorok meghatározzák a sejtek funkcióit - Az inger krónikus granulomatosus folyamatot idéz elő o A fagocitáló sejtekben károsodott vagy hiányzanak az ölő mechanizmusok o Olyan anyag (mycobacterium, azbeszt, szilikát) kerül a szervezetbe, amelyet a fagociták nem tudnak lebontani - Krónikus gyulladás szakaszai: 1. gyulladásos fázis: endothelsejtek, monocyta –ma rendszer (thrombocyták, NG-ák, ly-ák) 2. proliferatios fázis: kötőszöveti sejtek migrációja, proliferatioja ECM szintézise, endothel –sejtek migrációja, proliferatioja angiogenesis 3. helyreállítás és/vagy a fibrosisos elváltozások kialakulása: a gyulladást kiváltó citokinek további szekréciója sejtmigrációt és a folyamat amplifikációját idézi elő krónikussá válik - Sejtek szerepe krónikus
gyulladásban: o Endothelsejt:IL-1, IL-6, TNF, PDGF, CSF-k, adhéziós molekulák, koagulatios faktorok o Macrophag/monocyta: PDGF, TGF-k, IL-1, IL-6, IL-8, TNF, INF-ek, CSF-ok, BFGF (bázikus fibroblast GF), FAF (fibroblast aktiváló faktor) o Fibroblast: PDGF, IL-1, IL-6, CSF-k, adhéziós molekulák, proteoglikánok o Thrombocyta: PDGF, TGF –β, BFGF, PF4, véralvadási faktorok, adhéziós molekulák, AA kaszkád elemei o NG: reaktív oxigén metabolitok, adhéziós molekulák, enzimek, biokatív lipidek (PAF, AA metabolitok) o T –ly: IL-2, IL-3, IL-4, IL-6, IL-8, IL-9, FAF, INF-γ, LIF (leukémia inhibitor faktor), MCSF, GM-CSF, TGF -β 12




 Just like you draw up a plan when you’re going to war, building a house, or even going on vacation, you need to draw up a plan for your business. This tutorial will help you to clearly see where you are and make it possible to understand where you’re going.
Just like you draw up a plan when you’re going to war, building a house, or even going on vacation, you need to draw up a plan for your business. This tutorial will help you to clearly see where you are and make it possible to understand where you’re going.